题目内容
9.化合物AX3和单质X2在一定条件下反应可生成化合物AX5.已知AX3的熔点和沸点分别为-93.6℃和76℃,AX5的熔点为167℃.室温时AX3与气体X2反应生成1mol AX5,放出热量123.8kJ.该反应的热化学方程式为AX3(l)+X2(g)=AX5(s)△H=-123.8kJ•mol-1.分析 根据熔沸点判断出常温下各物质状态,根据生成物与放出热量的关系,计算出反应热,再据此写出热化学方程式.
解答 解:室温时,AX3为液态,AX5为固态,生成1mol AX5,放出热量123.8kJ,该反应的热化学方程为:AX3(l)+X2(g)=AX5(s)△H=-123.8kJ•mol-1,
故答案为:AX3(l)+X2(g)=AX5(s)△H=-123.8kJ•mol-1.
点评 本题考查了热化学方程式的书写,难度中等,关键是要学生能正确理解气体物质的量和反应热量的关系,并由此进行计算,

练习册系列答案
 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案
相关题目
4.下列说法中,错误的是(( )
| A. | 浓硫酸常见的特性是吸水性、脱水性、氧化性 | |
| B. | 浓硫酸也具有酸性,在常温下能够与活泼金属铁、铝等反应放出氢气 | |
| C. | 氟化氢的热稳定性很好,具有极弱的还原性,为一元弱酸 | |
| D. | SO2、SO3都是酸性氧化物,具有酸性氧化物的通性 |
5.将amL的乙炔气体,通入盛有bg苯的试管中.则所得混合物中碳的质量分数为( )
| A. | $\frac{12}{13}$ | B. | $\frac{1}{7}$ | C. | $\frac{6}{7}$ | D. | 无法确定 |
14.已知1-18号元素的离子aW3+、b X+、CY2-、d Z- 都具有相同的电子层结构,则下列叙述或表示方法正确的是( )
| A. | 四种元素位于同一周期 | B. | 氢化物的稳定性H2Y>HZ | ||
| C. | 离子的氧化性aW3+>bX+ | D. | 原子序数:c>b |
1.用如图装置能达到有关实验目的是( )
| A. |  电解精炼铝 | B. | 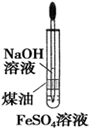 制备Fe(OH)3 | ||
| C. | 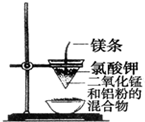 可制得金属锰 | D. | 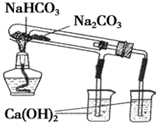 验证NaHCO3和Na2CO3的热稳定性 |
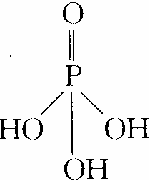 ),三聚磷酸钠是常用的水处理剂,次磷酸钠(Nail2Pa)可用于化学镀镍等等.完成下列填空:
),三聚磷酸钠是常用的水处理剂,次磷酸钠(Nail2Pa)可用于化学镀镍等等.完成下列填空: