题目内容
4.下列说法中,错误的是(( )| A. | 浓硫酸常见的特性是吸水性、脱水性、氧化性 | |
| B. | 浓硫酸也具有酸性,在常温下能够与活泼金属铁、铝等反应放出氢气 | |
| C. | 氟化氢的热稳定性很好,具有极弱的还原性,为一元弱酸 | |
| D. | SO2、SO3都是酸性氧化物,具有酸性氧化物的通性 |
分析 A、浓硫酸具有三大特性;
B、常温下与铁与铝发生钝化,不产生氢气;
C、氟的非金属性强,对应氢化物的稳定性好,氢化物的还原性弱的一元弱酸;
D、SO2、SO3都能与碱反应生成相应的盐与水.
解答 解:A、浓硫酸具有吸水性、脱水性、氧化性,故A正确;
B、常温下与铁与铝发生钝化,不产生氢气,故B错误;
C、氟的非金属性强,对应氢化物的稳定性好,氢化物的还原性弱的一元弱酸,故C正确;
D、SO2、SO3都能与碱反应生成相应的盐与水,是酸性氧化物,具有酸性氧化物的通性,故D正确;
故选B.
点评 本题考查浓硫酸的性质,题目难度不大,注意相关基础知识的积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14. 研究小组用如图装置制取Cl2,证明产生的气体中含有HCl.
研究小组用如图装置制取Cl2,证明产生的气体中含有HCl.
(1)仪器A的名称为圆底烧瓶;A中反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+2H2O+Mn2+;
(2)甲同学将A中产生的气体通入如表溶液:
①实验a中的现象为先变红后褪色;
②不能证明产生的气体中含有HCl的实验是ab(填字母序号);
(3)已知将HCl气体通入饱和食盐水中有白色固体析出.乙同学将A中产生的气体通入饱和食盐水中,有白色固体析出,但该实验不能证明气体中含有HCl,结合化学用语解释其原因Cl2+H2O?HCl+HClO,Cl2溶于水后使得溶液中的c(Cl-)增大,也能析出晶体;
(4)已知:2S2O32-+I2═S4O62-+2I-.丙同学将A中产生的气体通入蒸馏水中,得到溶液X,进行以下实验证明气体中含有HCl.
I.测定X中溶解的Cl2.取25.00mL溶液X,加入过量KI溶液,然后用0.04mol•L-1 Na2S2O3溶液滴定生成
的I2,达滴定终点时消耗Na2S2O3溶液V mL.
Ⅱ.测定X中Cl元素总量.另取25.00mL溶液X,选用适当的还原剂将溶解的Cl2全部还原为Cl-,再用0.10mol•L-1 AgNO3溶液滴定所得溶液中的Cl-.
①X中的HClO不会影响I的测定结果,原因是生成1mol HClO需消耗1mol Cl2,HClO也有氧化性,1mol HClO和1mol Cl2均能将2mol KI氧化成I2;
②由I、Ⅱ中实验数据可证明A中产生的气体中含有HCl,则Ⅱ中消耗0.10mol•L-1 AgNO3溶液的体积应大于0.4VmL(用含V的代数式表示).
 研究小组用如图装置制取Cl2,证明产生的气体中含有HCl.
研究小组用如图装置制取Cl2,证明产生的气体中含有HCl.(1)仪器A的名称为圆底烧瓶;A中反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+2H2O+Mn2+;
(2)甲同学将A中产生的气体通入如表溶液:
| 实验序号 | 试剂 | 现象 |
| a | 紫色石蕊溶液 | 先变红后褪色 |
| b | AgNO3溶液 | 出现白色沉淀 |
②不能证明产生的气体中含有HCl的实验是ab(填字母序号);
(3)已知将HCl气体通入饱和食盐水中有白色固体析出.乙同学将A中产生的气体通入饱和食盐水中,有白色固体析出,但该实验不能证明气体中含有HCl,结合化学用语解释其原因Cl2+H2O?HCl+HClO,Cl2溶于水后使得溶液中的c(Cl-)增大,也能析出晶体;
(4)已知:2S2O32-+I2═S4O62-+2I-.丙同学将A中产生的气体通入蒸馏水中,得到溶液X,进行以下实验证明气体中含有HCl.
I.测定X中溶解的Cl2.取25.00mL溶液X,加入过量KI溶液,然后用0.04mol•L-1 Na2S2O3溶液滴定生成
的I2,达滴定终点时消耗Na2S2O3溶液V mL.
Ⅱ.测定X中Cl元素总量.另取25.00mL溶液X,选用适当的还原剂将溶解的Cl2全部还原为Cl-,再用0.10mol•L-1 AgNO3溶液滴定所得溶液中的Cl-.
①X中的HClO不会影响I的测定结果,原因是生成1mol HClO需消耗1mol Cl2,HClO也有氧化性,1mol HClO和1mol Cl2均能将2mol KI氧化成I2;
②由I、Ⅱ中实验数据可证明A中产生的气体中含有HCl,则Ⅱ中消耗0.10mol•L-1 AgNO3溶液的体积应大于0.4VmL(用含V的代数式表示).
15.合成导电高分子材料PPV的反应

下列说法正确的是( )

下列说法正确的是( )
| A. | 该反应为缩聚反应 | |
| B. | PPV是聚苯乙炔 | |
| C. | PPV与聚苯乙烯的最小结构单元组成相同 | |
| D. | 1 mol  最多可与2 mol H2发生反应 最多可与2 mol H2发生反应 |
19. 研究表明,在CuZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:
研究表明,在CuZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1 平衡常数K1 反应Ⅰ
CO2(g)+H2(g)?CO(g)+H2O(g)△H2=+41.2kJ•mol-8平衡常数K2 反应Ⅱ
某实验室控制CO2和H2初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如表实验数据:
[备注]Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性;转化的CO2中生成甲醇的百分比
(1)合成的甲醇可用于燃料电池的燃料,若电解质为稀烧碱溶液时甲醇燃料电池的正极反应式为O2+4e-+2H2O=4OH-;研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在阴极,该电极反应式是CO2+6e-+6H+=CH3OH+H2O.
(2)从表中实验数据可以分析出,提高CO2转化成CH3OH的选择性的方法有使用Cat2催化剂(或理想催化剂);温度为543K(或降低温度).
(3)反应CO(g)+2H2(g)?CH3OH(g)的平衡常数K3=$\frac{{K}_{1}}{{K}_{2}}$(用K1和K2表示).
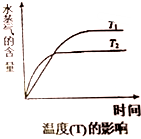
(4)在恒压密闭容器中,由CO2和H2进行反应I合成甲醇,在其它条件不变的情况下,探究温度对化学平衡的影响,实验结果如图.
①△H1<0(填“>”、“<”或“=”)
②有利于提高CO2平衡转化率的措施有A(填标号).
A.降低反应温度
B.投料比不变,增加反应物的浓度
C.增大CO2和H2的初始投料比
D.混合气体中掺入一定量惰性气体(不参与反应)
(5)在T1温度时,将1.00molCO2和3.00molH2充入体积为1.00L的恒容密闭容器中,容器起始压强为P0,仅进行反应I.
①充分反应达到平衡后,若CO2转化率为a,则容器的压强与起始压强之比为$\frac{2-a}{2}$(用a表示).
②若经过3h反应达到平衡,平衡后,混合气体物质的量为3.00mol,则该过程中H2的平均反应速率为0.5mol•L-1•h-1(保留三位有效数字);该温度下反应的化学平衡常数K为0.148(L•mol-1)2(保留三位有效数字);平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数.写出上述反应压力平衡常数KP为$\frac{64}{27{P}_{0}^{2}}$(用P0表示,并化简).
 研究表明,在CuZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:
研究表明,在CuZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1 平衡常数K1 反应Ⅰ
CO2(g)+H2(g)?CO(g)+H2O(g)△H2=+41.2kJ•mol-8平衡常数K2 反应Ⅱ
某实验室控制CO2和H2初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如表实验数据:
| T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
| 543 | Cat.1 | 12.3 | 42.3 |
| 543 | Cat.2 | 10.9 | 72.7 |
| 553 | Cat.1 | 15.3 | 39.1 |
| 553 | Cat.2 | 12.0 | 71.6 |
(1)合成的甲醇可用于燃料电池的燃料,若电解质为稀烧碱溶液时甲醇燃料电池的正极反应式为O2+4e-+2H2O=4OH-;研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在阴极,该电极反应式是CO2+6e-+6H+=CH3OH+H2O.
(2)从表中实验数据可以分析出,提高CO2转化成CH3OH的选择性的方法有使用Cat2催化剂(或理想催化剂);温度为543K(或降低温度).
(3)反应CO(g)+2H2(g)?CH3OH(g)的平衡常数K3=$\frac{{K}_{1}}{{K}_{2}}$(用K1和K2表示).
(4)在恒压密闭容器中,由CO2和H2进行反应I合成甲醇,在其它条件不变的情况下,探究温度对化学平衡的影响,实验结果如图.
①△H1<0(填“>”、“<”或“=”)
②有利于提高CO2平衡转化率的措施有A(填标号).
A.降低反应温度
B.投料比不变,增加反应物的浓度
C.增大CO2和H2的初始投料比
D.混合气体中掺入一定量惰性气体(不参与反应)
(5)在T1温度时,将1.00molCO2和3.00molH2充入体积为1.00L的恒容密闭容器中,容器起始压强为P0,仅进行反应I.
①充分反应达到平衡后,若CO2转化率为a,则容器的压强与起始压强之比为$\frac{2-a}{2}$(用a表示).
②若经过3h反应达到平衡,平衡后,混合气体物质的量为3.00mol,则该过程中H2的平均反应速率为0.5mol•L-1•h-1(保留三位有效数字);该温度下反应的化学平衡常数K为0.148(L•mol-1)2(保留三位有效数字);平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数.写出上述反应压力平衡常数KP为$\frac{64}{27{P}_{0}^{2}}$(用P0表示,并化简).
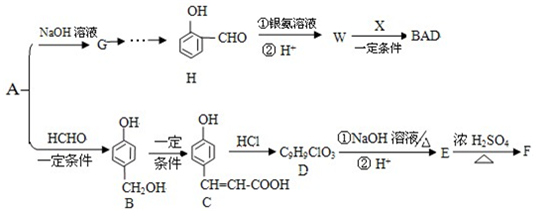
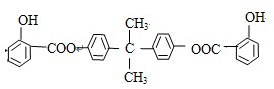
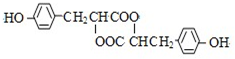
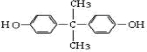 ,推测B的核磁共振氢谱中显示有5种不同化学环境的氢原子.
,推测B的核磁共振氢谱中显示有5种不同化学环境的氢原子. .
.
 .
. .
. .
.