题目内容
4.现将0.1mol某烃完全燃烧生成的气体全部依次通过浓硫酸和氢氧化钠溶液,经测定,前者增重10.8g,后者增重22g(假定气体全部吸收).(1)试通过计算推断该烃的分子式C5H12.
(2)若该烃的一氯代物只有一种,试写出该烃的结构简式:C(CH3)4.
分析 浓硫酸具有吸水性,增重10.8g,为水的质量,可求得烃中H原子个数,生成物通入NaOH溶液,增重的质量为二氧化碳的质量,可求得烃中C原子个数,以此可求得烃的分子式.
解答 解:(1)浓硫酸具有吸水性,增重10.8g,为水的质量,则n(H2O)=$\frac{10.8g}{18g/mol}$=0.6mol,n(H)=2n(H2O)=2×0.6mol=1.2mol,即0.1mol烃中含有1.2molH原子,所以该烃分子中H原子个数为12;
生成物通入NaOH溶液,增重的22g质量为二氧化碳的质量,则n(CO2)=$\frac{22g}{44g/mol}$=0.5mol,n(C)=n(CO2)=0.5mol,即0.1mol烃中含有0.5molC原子,所以该烃分子中C原子个数为5;则该烃的分子式为C5H12,
故答案为:C5H12;
(2)分子式为C5H12,的烃为戊烷,戊烷存在正戊烷、异戊烷和新戊烷三种同分异构体;若该烃的1个氢原子被氯原子取代得到的一氯代物只有一种,则该戊烷分子中只含有1种等效H,应该为新戊烷,其结构简式为C(CH3)4.
故答案为:C(CH3)4.
点评 本题考查了有机物分子式、结构简式的确定,题目难度中等,注意掌握常见有机物结构与性质,明确质量守恒定律在确定有机物分子式中的应用方法.

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
19. 研究表明,在CuZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:
研究表明,在CuZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1 平衡常数K1 反应Ⅰ
CO2(g)+H2(g)?CO(g)+H2O(g)△H2=+41.2kJ•mol-8平衡常数K2 反应Ⅱ
某实验室控制CO2和H2初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如表实验数据:
[备注]Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性;转化的CO2中生成甲醇的百分比
(1)合成的甲醇可用于燃料电池的燃料,若电解质为稀烧碱溶液时甲醇燃料电池的正极反应式为O2+4e-+2H2O=4OH-;研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在阴极,该电极反应式是CO2+6e-+6H+=CH3OH+H2O.
(2)从表中实验数据可以分析出,提高CO2转化成CH3OH的选择性的方法有使用Cat2催化剂(或理想催化剂);温度为543K(或降低温度).
(3)反应CO(g)+2H2(g)?CH3OH(g)的平衡常数K3=$\frac{{K}_{1}}{{K}_{2}}$(用K1和K2表示).
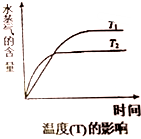
(4)在恒压密闭容器中,由CO2和H2进行反应I合成甲醇,在其它条件不变的情况下,探究温度对化学平衡的影响,实验结果如图.
①△H1<0(填“>”、“<”或“=”)
②有利于提高CO2平衡转化率的措施有A(填标号).
A.降低反应温度
B.投料比不变,增加反应物的浓度
C.增大CO2和H2的初始投料比
D.混合气体中掺入一定量惰性气体(不参与反应)
(5)在T1温度时,将1.00molCO2和3.00molH2充入体积为1.00L的恒容密闭容器中,容器起始压强为P0,仅进行反应I.
①充分反应达到平衡后,若CO2转化率为a,则容器的压强与起始压强之比为$\frac{2-a}{2}$(用a表示).
②若经过3h反应达到平衡,平衡后,混合气体物质的量为3.00mol,则该过程中H2的平均反应速率为0.5mol•L-1•h-1(保留三位有效数字);该温度下反应的化学平衡常数K为0.148(L•mol-1)2(保留三位有效数字);平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数.写出上述反应压力平衡常数KP为$\frac{64}{27{P}_{0}^{2}}$(用P0表示,并化简).
 研究表明,在CuZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:
研究表明,在CuZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1 平衡常数K1 反应Ⅰ
CO2(g)+H2(g)?CO(g)+H2O(g)△H2=+41.2kJ•mol-8平衡常数K2 反应Ⅱ
某实验室控制CO2和H2初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如表实验数据:
| T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
| 543 | Cat.1 | 12.3 | 42.3 |
| 543 | Cat.2 | 10.9 | 72.7 |
| 553 | Cat.1 | 15.3 | 39.1 |
| 553 | Cat.2 | 12.0 | 71.6 |
(1)合成的甲醇可用于燃料电池的燃料,若电解质为稀烧碱溶液时甲醇燃料电池的正极反应式为O2+4e-+2H2O=4OH-;研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在阴极,该电极反应式是CO2+6e-+6H+=CH3OH+H2O.
(2)从表中实验数据可以分析出,提高CO2转化成CH3OH的选择性的方法有使用Cat2催化剂(或理想催化剂);温度为543K(或降低温度).
(3)反应CO(g)+2H2(g)?CH3OH(g)的平衡常数K3=$\frac{{K}_{1}}{{K}_{2}}$(用K1和K2表示).
(4)在恒压密闭容器中,由CO2和H2进行反应I合成甲醇,在其它条件不变的情况下,探究温度对化学平衡的影响,实验结果如图.
①△H1<0(填“>”、“<”或“=”)
②有利于提高CO2平衡转化率的措施有A(填标号).
A.降低反应温度
B.投料比不变,增加反应物的浓度
C.增大CO2和H2的初始投料比
D.混合气体中掺入一定量惰性气体(不参与反应)
(5)在T1温度时,将1.00molCO2和3.00molH2充入体积为1.00L的恒容密闭容器中,容器起始压强为P0,仅进行反应I.
①充分反应达到平衡后,若CO2转化率为a,则容器的压强与起始压强之比为$\frac{2-a}{2}$(用a表示).
②若经过3h反应达到平衡,平衡后,混合气体物质的量为3.00mol,则该过程中H2的平均反应速率为0.5mol•L-1•h-1(保留三位有效数字);该温度下反应的化学平衡常数K为0.148(L•mol-1)2(保留三位有效数字);平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数.写出上述反应压力平衡常数KP为$\frac{64}{27{P}_{0}^{2}}$(用P0表示,并化简).
20.某原子用符号${\;}_{15}^{36}$P表示,其核电荷数是( )
| A. | 31个 | B. | 15个 | C. | 30个 | D. | 36个 |
19.下列说法不正确的是( )
| A. | 物质的量就是物质的质量 | |
| B. | 摩尔是物质的量的单位,简称摩,符号为mol | |
| C. | 物质的量是含有一定数目粒子的集合体 | |
| D. | H2的摩尔质量为2g/mol |
16.下列晶体熔化时不需破坏化学键的是( )
| A. | 晶体硅 | B. | 食盐 | C. | 固体碘 | D. | 金属钾 |
 已知尿素(结构简式:
已知尿素(结构简式: )可用于制有机铁肥三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3.回答下列问题.
)可用于制有机铁肥三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3.回答下列问题.