题目内容
10.标况下体积为1.12LNH3的物质的量为0.05,用NA表示总共含有0.2NA个原子,将它溶于水形成1L溶液,所得溶液的物质的量溶度为0.05mol/L.分析 根据n=$\frac{V}{{V}_{m}}$计算出氨气的物质的量,结合氨气分子组成计算出含有原子的物质的量及数目;根据c=$\frac{n}{V}$计算出所得溶液的物质的量浓度.
解答 解:标况下体积为1.12LNH3的物质的量为:n(NH3)=$\frac{1.12L}{22.4L/mol}$=0.05mol,0.05mol氨气分子中含有原子的物质的量为:0.05mol×4=0.2mol,含有0.2NA个原子,
将0.05mol氨气溶于1L水中,所得溶液的物质的量浓度为:$\frac{0.05mol}{1L}$=0.05mol/L,
故答案为:0.05mol;0.2NA;0.05mol/L.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与气体摩尔体积、物质的量浓度、阿伏伽德罗常数等之间的关系即可解答,试题培养了学生的化学计算能力.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目
2.利用如图制取氨气,说法正确的是( )


| A. | 该装置可用于氯化铵和熟石灰制取氨气 | |
| B. | 该装置可用于碳酸氢铵分解制取氨气 | |
| C. | 用湿润的棉花堵在试管口,防止氨气扩散 | |
| D. | 用蘸有浓硫酸的玻璃棒置于试管口验满 |
18.下列物质中既能与稀H2SO4反应,又能与NaOH溶液反应的是( )
①NaHCO3②Al2O3③Al(OH)3④Al⑤AlCl3⑥Na2CO3.
①NaHCO3②Al2O3③Al(OH)3④Al⑤AlCl3⑥Na2CO3.
| A. | ②③④ | B. | ①②③④ | C. | ①③④ | D. | 全部 |
5.下列原子轨道重叠时,能形成π键的是( )
| A. | 只有py与py | B. | 只有pz与pz | ||
| C. | 只有dxy与py | D. | 上述三种情况都能 |
2.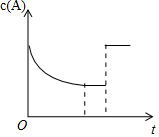 一定温度下,将一定量的A、B气体充入密闭容器,发生反应:A(g)+B(g)?xC(g)+3D(?),反应平衡后,改变影响平衡的一个条件,物质A的浓度变化如图所示.下列有关说法正确的是( )
一定温度下,将一定量的A、B气体充入密闭容器,发生反应:A(g)+B(g)?xC(g)+3D(?),反应平衡后,改变影响平衡的一个条件,物质A的浓度变化如图所示.下列有关说法正确的是( )
 一定温度下,将一定量的A、B气体充入密闭容器,发生反应:A(g)+B(g)?xC(g)+3D(?),反应平衡后,改变影响平衡的一个条件,物质A的浓度变化如图所示.下列有关说法正确的是( )
一定温度下,将一定量的A、B气体充入密闭容器,发生反应:A(g)+B(g)?xC(g)+3D(?),反应平衡后,改变影响平衡的一个条件,物质A的浓度变化如图所示.下列有关说法正确的是( )| A. | x=2,C为气态,D可能为气态也可能为非气态 | |
| B. | 改变的条件可能是使用了催化剂 | |
| C. | 其他条件不变,若向容器中再加入少量C,平衡逆向移动但平衡常数不变 | |
| D. | 该反应的化学平衡常数K=$\frac{{c}^{2}(C)}{[c(A)•c(B)]}$,且温度升高,K值增大 |
 某温度下的溶液中c(H+)=1.0×10x mol/L,c(OH-)=1.0×10y mol/L.x与y的关系如图所示.请回答下列问题:
某温度下的溶液中c(H+)=1.0×10x mol/L,c(OH-)=1.0×10y mol/L.x与y的关系如图所示.请回答下列问题: 室温时向100mL,0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液,得到溶液PH与NaOH溶液体积的关系曲线如图B所示:
室温时向100mL,0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液,得到溶液PH与NaOH溶液体积的关系曲线如图B所示: