题目内容
某100mL稀硝酸溶液与过量铁粉发生反应:
(1)写出该化学方程式并用双线桥标出电子转移的方向和数目 .
(2)该反应的氧化剂是 ,还原产物是 .
(3)标准状况下,当生成2.24L气体产生时,有 g Fe参加反应,转移的电子总数为 个,原稀硝酸溶液的浓度是 .(假设反应前后溶液体积变化忽略不计).
(1)写出该化学方程式并用双线桥标出电子转移的方向和数目
(2)该反应的氧化剂是
(3)标准状况下,当生成2.24L气体产生时,有
考点:氧化还原反应的计算,氧化还原反应
专题:
分析:(1)发生3Fe+8HNO3 (稀)=3Fe(NO3)2 +2NO↑+4H2O,Fe失去电子,N得到电子,该反应转移6e-;
(2)N元素的化合价降低,得到电子被还原;
(3)n(NO)=
=0.1mol,结合反应及元素的化合价变化、c=
计算.
(2)N元素的化合价降低,得到电子被还原;
(3)n(NO)=
| 2.24L |
| 22.4L/mol |
| n |
| V |
解答:
解:(1)稀硝酸溶液与过量铁粉发生反应3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,反应中Fe元素化合价由0价升高到+2价,失电子被氧化,N元素化合价由+5价降低到+2价,得电子被还原,化合价变化的最小公倍数为6,则电子的转移方向和数目可表示为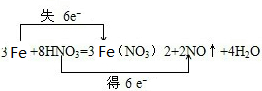 ,
,
故答案为: ;
;
(2)N元素的化合价降低,得到电子被还原,则氧化剂为HNO3,还原产物为NO,故答案为:HNO3;NO;
(3)n(NO)=
=0.1mol,由反应可知,m(Fe)=0.1mol×
×56g/mol=8.4g,转移电子为0.1mol×(5-2)×NA=0.3NA,原稀硝酸溶液的浓度是
=4mol/L,故答案为:8.4;0.3NA;4mol/L.
 ,
,故答案为:
 ;
;(2)N元素的化合价降低,得到电子被还原,则氧化剂为HNO3,还原产物为NO,故答案为:HNO3;NO;
(3)n(NO)=
| 2.24L |
| 22.4L/mol |
| 3 |
| 2 |
0.1mol×
| ||
| 0.1L |
点评:本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化及物质的量的关系等为解答的关键,侧重分析与计算能力的考查,注意电子转移的表示方法,题目难度不大.

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
下列各物质,按照单质、氧化物、混合物分类,排列正确的是( )
| A、冰、干冰、水玻璃 |
| B、氮气、氧气、小苏打 |
| C、有液氯、冰水、漂粉精 |
| D、氯气、铁红、胆矾 |
700℃时,向容积不变的1L密闭容器中充人一定量的CO和H2O,发生反应:CO(g)+H2O(g)?CO2(g)+H2(g)反应过程中测定的部分数据见下表(表中t1<t2)下列说法不正确的是( )
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
A、O-t1 min的平均反应速率为v(H2)=
| ||
| B、保持其他条件不变,若容器内的压强不改变时,该反应一定达到了化学平衡状态 | ||
| C、保持其他条件不变,若起始时向容器中充入0.60mol CO和1.20mol H2O,则达到平衡时n(CO2)=0.40mol | ||
| D、保持其他条件不变,向平衡体系中再通入0.20mol H2O,与原平衡相比,达到新平衡时CO的转化率增大,CO2的浓度增大 |
下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是( )
| A、SO2和SiO2 |
| B、HCl和AlCl3 |
| C、NaCl和NaOH |
| D、CCl4和KCl |


 利用图装置进行下列实验,能得出相应实验结论的是( )
利用图装置进行下列实验,能得出相应实验结论的是( )