题目内容
镁、铝、锌是生活中常见的三种金属,查阅资料获得如下信息:
①镁、铝、锌都是银白色的金属
②锌(Zn)可以与NaOH溶液反应生成H2
③Zn(OH)2为白色固体,难溶于水,可溶于强碱及NH3?H2O,
④Zn2+易形成配合物如[Zn(NH3)4]2+,该络合物遇强酸分解生成Zn2+、NH4+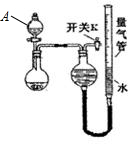
(1)甲同学取镁铝合金进行定量分析,用右图所示装置进行实验.获得如下数据(所有气体体积均已换算成标准状况.忽略滴入液体体积对气体体积的影响)
①查该装置的气密性的方法是
②若分液漏斗装的是NaOH溶液,则圆底烧瓶中发生反应的离子方程式为
③计算出镁铝合金中镁的质量分数为
④本实验对量气管多次读数,读数时应注意:a将实验装置恢复到室温,b ,c
(2)乙同学取镁铝锌合金设计如下实验方案:
(可用试剂:样品、PH试纸、稀硫酸、NaOH溶液,氨水)
①试剂M ;沉淀B是
②操作Ⅰ是:在滤液中逐滴加入 直至生成的沉淀刚好溶解,再加入足量的 ,过滤.
③沉淀C与氨水反应的离子方程式为 .
①镁、铝、锌都是银白色的金属
②锌(Zn)可以与NaOH溶液反应生成H2
③Zn(OH)2为白色固体,难溶于水,可溶于强碱及NH3?H2O,
④Zn2+易形成配合物如[Zn(NH3)4]2+,该络合物遇强酸分解生成Zn2+、NH4+

(1)甲同学取镁铝合金进行定量分析,用右图所示装置进行实验.获得如下数据(所有气体体积均已换算成标准状况.忽略滴入液体体积对气体体积的影响)
| 编号 | 粉末质量 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 2.0g | 10.0mL | 346.2mL |
| ② | 2.0g | 10.0mL | 335.0mL |
| ③ | 2.0g | 10.0mL | 345.8mL |
②若分液漏斗装的是NaOH溶液,则圆底烧瓶中发生反应的离子方程式为
③计算出镁铝合金中镁的质量分数为
④本实验对量气管多次读数,读数时应注意:a将实验装置恢复到室温,b
(2)乙同学取镁铝锌合金设计如下实验方案:
(可用试剂:样品、PH试纸、稀硫酸、NaOH溶液,氨水)

①试剂M
②操作Ⅰ是:在滤液中逐滴加入
③沉淀C与氨水反应的离子方程式为
考点:探究物质的组成或测量物质的含量
专题:
分析:(1)①关闭分液漏斗和开关K,在量气管中加入水至产生液面差,静置后不变化证明气密性完好;
②镁铝合金加入氢氧化钠溶液,铝和氢氧化钠溶液反应生成偏铝酸钠和氢气;
③实验中,实验②数值误差太大舍去,铝和氢氧化钠反应,根据量气管的第二次读数-第一次读数=生成氢气的体积,求出生成氢气的平均值,再求出合金中铝的质量,最后计算出镁铝合金中铝的质量分数;
④对量气管读数时,首先等实验装置恢复到室温再进行下一步操作,然后调节量气管使左右液面相平,最后读数时视线与凹液面最低处相平;
(2)Wg镁铝锌合金加入稀硫酸溶解生成硫酸镁、硫酸铝溶液、硫酸锌溶液,加入试剂M为过量氢氧化钠溶液,得到沉淀A为Mg(OH)2,滤液为Na2ZnO2,NaAlO2溶液,加入过量稀硫酸得到硫酸铝溶液、硫酸锌溶液,再加入足量氨水溶液得到沉淀B为Al(OH)3,滤液为Zn2+易形成配合物如[Zn(NH3)4]2+,该络合物遇强酸分解生成Zn2+、NH4+,加入适量氢氧化钠溶液得到C为氢氧化锌沉淀.
②镁铝合金加入氢氧化钠溶液,铝和氢氧化钠溶液反应生成偏铝酸钠和氢气;
③实验中,实验②数值误差太大舍去,铝和氢氧化钠反应,根据量气管的第二次读数-第一次读数=生成氢气的体积,求出生成氢气的平均值,再求出合金中铝的质量,最后计算出镁铝合金中铝的质量分数;
④对量气管读数时,首先等实验装置恢复到室温再进行下一步操作,然后调节量气管使左右液面相平,最后读数时视线与凹液面最低处相平;
(2)Wg镁铝锌合金加入稀硫酸溶解生成硫酸镁、硫酸铝溶液、硫酸锌溶液,加入试剂M为过量氢氧化钠溶液,得到沉淀A为Mg(OH)2,滤液为Na2ZnO2,NaAlO2溶液,加入过量稀硫酸得到硫酸铝溶液、硫酸锌溶液,再加入足量氨水溶液得到沉淀B为Al(OH)3,滤液为Zn2+易形成配合物如[Zn(NH3)4]2+,该络合物遇强酸分解生成Zn2+、NH4+,加入适量氢氧化钠溶液得到C为氢氧化锌沉淀.
解答:
解:(1)①关闭分液漏斗和开关K,在量气管中加入水至产生液面差,静置后不变化证明气密性完好,具体步骤为:关闭分液漏斗活塞和开关K,向量气管中加水至两端产生液面差,记录刻度,静置一段时间后,刻度不变,证明气密性良好;
故答案为:关闭分液漏斗活塞和开关K,向量气管中加水至两端产生液面差,记录刻度,静置一段时间后,刻度不变,证明气密性良好;
②镁铝合金加入氢氧化钠溶液,铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑;
故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;
③第2次测量数据误差较大,可不用,铝和氢氧化钠反应生成氢气的体积=
=336.0mL=0.336L
设生成0.336L氢气,需铝的质量为x
2Al+2NaOH+2H2O═2NaAlO2+3H2↑
54g 3×22.4L
x 0.336L
=
,解之得:x=0.27g
铝的质量分数=
×100%=13.5%.
则合金中含镁质量分数为86.5%;
故答案为:86.5%;
④根据PV=nRT,为保证测出来的气体体积是当时大气压下的体积,在读数时应注意:a、将实验装置恢复到室温,b、使量气管两端液面相平,因为相平说明两边液面上的压强是一样的,这样测出来的气体体积才是当时大气压下的体积,c、视线与凹液面最低处相平,俯视或仰视会造成误差;
故答案为:调整量气管至两端液面相平,视线与凹液面最低处相平;
(2)Wg镁铝锌合金加入稀硫酸溶解生成硫酸镁、硫酸铝溶液、硫酸锌溶液,加入试剂M为过量氢氧化钠溶液,得到沉淀A为Mg(OH)2,滤液为Na2ZnO2,NaAlO2溶液,加入过量稀硫酸得到硫酸铝溶液、硫酸锌溶液,再加入足量氨水溶液得到沉淀B为Al(OH)3,滤液为Zn2+易形成配合物如[Zn(NH3)4]2+,该络合物遇强酸分解生成Zn2+、NH4+,加入适量氢氧化钠溶液得到C为氢氧化锌沉淀;
①上述分析可知,试剂M为氢氧化钠溶液,沉淀B为Al(OH)3;
故答案为:NaOH溶液;Al(OH)3;
②操作Ⅰ是:在滤液中逐滴加入稀硫酸溶液直至生成的沉淀刚好溶解,再加入足量的氨水溶液沉淀铝离子,过滤得到氢氧化铝沉淀.
故答案为:稀硫酸;稀氨水;
③Zn(OH)2为白色固体,难溶于水,可溶于强碱及NH3?H2O,沉淀C与氨水反应的离子方程式为Zn(OH)2+4NH3=[Zn(NH3)4]2++2OH-;或Zn(OH)2+4NH3?H2O=[Zn(NH3)4]2++2OH-+4H2O;
故答案为:Zn(OH)2+4NH3=[Zn(NH3)4]2++2OH-;或Zn(OH)2+4NH3?H2O=[Zn(NH3)4]2++2OH-+4H2O.
故答案为:关闭分液漏斗活塞和开关K,向量气管中加水至两端产生液面差,记录刻度,静置一段时间后,刻度不变,证明气密性良好;
②镁铝合金加入氢氧化钠溶液,铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑;
故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;
③第2次测量数据误差较大,可不用,铝和氢氧化钠反应生成氢气的体积=
| 346.2-10+345.8-10 |
| 2 |
设生成0.336L氢气,需铝的质量为x
2Al+2NaOH+2H2O═2NaAlO2+3H2↑
54g 3×22.4L
x 0.336L
| 3×22.4 |
| 0.336 |
| 54 |
| x |
铝的质量分数=
| 0.27g |
| 2g |
则合金中含镁质量分数为86.5%;
故答案为:86.5%;
④根据PV=nRT,为保证测出来的气体体积是当时大气压下的体积,在读数时应注意:a、将实验装置恢复到室温,b、使量气管两端液面相平,因为相平说明两边液面上的压强是一样的,这样测出来的气体体积才是当时大气压下的体积,c、视线与凹液面最低处相平,俯视或仰视会造成误差;
故答案为:调整量气管至两端液面相平,视线与凹液面最低处相平;
(2)Wg镁铝锌合金加入稀硫酸溶解生成硫酸镁、硫酸铝溶液、硫酸锌溶液,加入试剂M为过量氢氧化钠溶液,得到沉淀A为Mg(OH)2,滤液为Na2ZnO2,NaAlO2溶液,加入过量稀硫酸得到硫酸铝溶液、硫酸锌溶液,再加入足量氨水溶液得到沉淀B为Al(OH)3,滤液为Zn2+易形成配合物如[Zn(NH3)4]2+,该络合物遇强酸分解生成Zn2+、NH4+,加入适量氢氧化钠溶液得到C为氢氧化锌沉淀;
①上述分析可知,试剂M为氢氧化钠溶液,沉淀B为Al(OH)3;
故答案为:NaOH溶液;Al(OH)3;
②操作Ⅰ是:在滤液中逐滴加入稀硫酸溶液直至生成的沉淀刚好溶解,再加入足量的氨水溶液沉淀铝离子,过滤得到氢氧化铝沉淀.
故答案为:稀硫酸;稀氨水;
③Zn(OH)2为白色固体,难溶于水,可溶于强碱及NH3?H2O,沉淀C与氨水反应的离子方程式为Zn(OH)2+4NH3=[Zn(NH3)4]2++2OH-;或Zn(OH)2+4NH3?H2O=[Zn(NH3)4]2++2OH-+4H2O;
故答案为:Zn(OH)2+4NH3=[Zn(NH3)4]2++2OH-;或Zn(OH)2+4NH3?H2O=[Zn(NH3)4]2++2OH-+4H2O.
点评:本题考查了实验探究物质组成的实验设计,反应过程分析判断,物质提纯的理解应用,主要是混合物分离的方法和物质性质的理解应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A、标准状况下,2.24L CH3OH含有的原子数为0.6NA |
| B、1 mol苯分子中含有的碳碳双键数为3NA |
| C、常温下,14.0g乙烯中含有的C-H键的数目为2NA |
| D、0.1mol氨基(-NH2)中电子数为NA |
反应3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)在温度和容积不变的条件下进行.下列叙述能表明反应达到平衡状态的是( )
| A、容器内压强不再改变 |
| B、v(H2O)=v(H2) |
| C、气体的密度不再改变 |
| D、反应不再进行 |
下列两种气体的分子数一定相等的是( )
| A、质量相等的N2和CO |
| B、等体积的N2和CO |
| C、等压等体积的N2和CO2 |
| D、等温等体积的O2和N2 |
如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )


| A、原子半径:Z>Y>X |
| B、气态氢化物的稳定性:W>R |
| C、WX3和水反应形成的化合物是离子化合物 |
| D、Y和Z两者最高价氧化物对应的水化物能相互反应 |

 甲、乙、丙、丁是原子序数不超过20的元素组成的物质(单质或化合物),且存在如下转化关系:甲+乙→丙+丁,依次回答下列问题:
甲、乙、丙、丁是原子序数不超过20的元素组成的物质(单质或化合物),且存在如下转化关系:甲+乙→丙+丁,依次回答下列问题: