题目内容
下列物质,能够直接通过化合反应制取的一组是( )
①FeCl2 ②FeCl3 ③FeS ④Fe(OH)3 ⑤Cu2S ⑥Cu(OH)2 ⑦H2SiO3.
①FeCl2 ②FeCl3 ③FeS ④Fe(OH)3 ⑤Cu2S ⑥Cu(OH)2 ⑦H2SiO3.
| A、②③⑤ | B、①②③⑤ |
| C、①②③④⑤ | D、全部 |
考点:铁的化学性质,铜金属及其重要化合物的主要性质
专题:
分析:①铁与氯化铁反应化合反应生成FeCl2;
②氯气具有强氧化性,铁与氯气反应生成FeCl3;
③硫具有弱氧化性,铁粉和硫粉混合加热生成硫化亚铁;
④氢氧化亚铁在空气中迅速被氧化成氢氧化铁;
⑤硫具有弱氧化性,铜和硫粉混合加热生成硫化亚铜;
⑥氧化铜与水不能一步化合生成氢氧化铜;
⑦二氧化硅与水不能一步化合生成硅酸.
②氯气具有强氧化性,铁与氯气反应生成FeCl3;
③硫具有弱氧化性,铁粉和硫粉混合加热生成硫化亚铁;
④氢氧化亚铁在空气中迅速被氧化成氢氧化铁;
⑤硫具有弱氧化性,铜和硫粉混合加热生成硫化亚铜;
⑥氧化铜与水不能一步化合生成氢氧化铜;
⑦二氧化硅与水不能一步化合生成硅酸.
解答:
解:①铁与氯化铁发生化合反应生成FeCl2,故①选;
②氯气具有强氧化性,和变价金属只生成高价金属氯化物,FeCl3可由Fe在Cl2中燃烧生成,故②选;
③硫具有弱氧化性,和变价金属只生成低价金属氯化物,铁粉和硫粉混合加热即生成硫化亚铁,故③选;
④氢氧化亚铁在空气中迅速被氧化成氢氧化铁,方程式为:4Fe(OH)2+O2+2H2O═4Fe(OH)3,故④选;
⑤硫的氧化性弱,和金属反应生成低价态的金属硫化物,铜和硫粉反应2Cu+S
Cu2S,故⑤选;
⑥氧化铜与水不能一步化合生成氢氧化铜,故⑥不选;
⑦二氧化硅与水不能一步化合生成硅酸,故⑦不选;
故选C.
②氯气具有强氧化性,和变价金属只生成高价金属氯化物,FeCl3可由Fe在Cl2中燃烧生成,故②选;
③硫具有弱氧化性,和变价金属只生成低价金属氯化物,铁粉和硫粉混合加热即生成硫化亚铁,故③选;
④氢氧化亚铁在空气中迅速被氧化成氢氧化铁,方程式为:4Fe(OH)2+O2+2H2O═4Fe(OH)3,故④选;
⑤硫的氧化性弱,和金属反应生成低价态的金属硫化物,铜和硫粉反应2Cu+S
| ||
⑥氧化铜与水不能一步化合生成氢氧化铜,故⑥不选;
⑦二氧化硅与水不能一步化合生成硅酸,故⑦不选;
故选C.
点评:本题考查常见金属和非金属的性质,熟练掌握常铁、铜、硫、氯气、氧气等物质的化学性质是解答的关键,题目难度不大,注意基础知识的积累.

练习册系列答案
相关题目
下列有关化学用语正确的是( )
A、NH4Cl的电子式: |
| B、含18个中子的氯原子的核素符号:1735Cl |
C、S2-的结构示意图: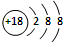 |
| D、次氯酸的结构式:H-O-Cl |
下列离子方程式书写正确的是( )
| A、赤铁矿投入到稀盐酸中:FeO+2H+═Fe2++H2O |
| B、FeCl3溶液中加入氢氧化钠溶液:Fe2++3OH-═Fe(OH)2↓ |
| C、三氯化铁溶液中加入铁粉:2Fe3++Fe═3Fe2+ |
| D、FeCl2溶液跟Cl2反应:Fe2++Cl2═Fe3++2Cl- |



 )反应生成的产物DBP(C16H22O4)是广泛使用的增塑剂之一.DBP有多种同分异构体,其中符合下列条件的DBP的同分异构体有
)反应生成的产物DBP(C16H22O4)是广泛使用的增塑剂之一.DBP有多种同分异构体,其中符合下列条件的DBP的同分异构体有 (1)中和热的测定是高中化学的定量实验之一.50mL0.50mol/L 盐酸与50mL 0.55mol/L NaOH 溶液在如图甲所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.从实验装置上看,图中尚缺少的一种仪器是
(1)中和热的测定是高中化学的定量实验之一.50mL0.50mol/L 盐酸与50mL 0.55mol/L NaOH 溶液在如图甲所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.从实验装置上看,图中尚缺少的一种仪器是 请按下列要求填空
请按下列要求填空