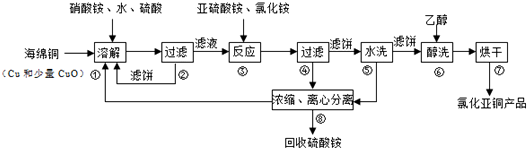
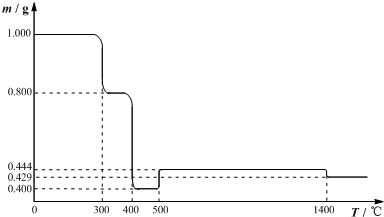
题目内容
13.下列叙述正确的是( )| A. | 氧化物是指含氧元素的化合物 | B. | 氧化物、酸、碱、盐都含氧元素 | ||
| C. | 碱性氧化物一定是金属氧化物 | D. | 酸性氧化物一定是非金属氧化物 |
分析 A、氧化物是由两种元素组成,其中一种元素是氧元素的化合物;
B、酸和盐中不一定含有氧元素;
C、金属氧化物分为碱性氧化物、酸性氧化物、两性氧化物、过氧化物等;
D、金属氧化物分为碱性氧化物、酸性氧化物、两性氧化物、过氧化物等.
解答 解:A、氧化物是由两种元素组成,其中一种元素是氧元素的化合物,含氧元素的化合物不一定含有2种元素,故A错误;
B、酸和盐中不一定含有氧元素,如盐酸、氯化钠,故B错误;
C、金属氧化物分为碱性氧化物、两性氧化物、过氧化物等,所以碱性氧化物一定是金属氧化物,故C正确;
D、金属氧化物分为碱性氧化物、两性氧化物、过氧化物等,所以酸性氧化物一定是非金属氧化物,如Mn2O7,故D错误;
故选C.
点评 本题考查物质的分类,题目难度不大,注意物质的分类方法和常见物质的种类与组成.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
3.下列说法正确的是( )
| A. | 电离平衡常数(K)越小,表示弱电解质电离能力越弱 | |
| B. | BaSO4难溶于水,但它是强电解质,氨水是弱电解质 | |
| C. | 强电解质是离子化合物,弱电解质是共价化合物 | |
| D. | 氨气溶于水,当c(OH-)=c(NH4+)时,表明氨水电离处于平衡状态 |
1.下列有关用惰性电极电解CuSO4溶液一段时间后的说法正确的是( )
| A. | 电解过程中阳极质量不变 | |
| B. | 电解过程中溶液的pH不断升高 | |
| C. | 此时向溶液中加入适量的Cu2O固体可使溶液恢复到电解前的状况 | |
| D. | 电解后两极产生的气体体积比为2:1 |
18.在pH=1无色溶液中,能大量共存的离子组是( )
| A. | Cu2+、Cl-、Mg2+、NO3- | B. | K+、Cl-、Mg2+、SO42- | ||
| C. | Fe3+、Na+、NO3-、Al3+ | D. | HCO3-、NH4+、Ag+、NO3- |
3.用NA表示阿伏加德罗常数的值.下列判断正确的是( )
| A. | 常温常压下,64 g SO2含有的原子数目为NA | |
| B. | 常温常压下,22.4 L O2含有的分子数目为NA | |
| C. | 1 mol镁与足量稀硫酸反应时失去的电子数目为2 NA | |
| D. | 1 mol•L-1K2SO4溶液中含有的钾离子数目为2 NA |
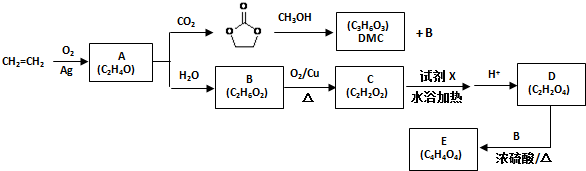
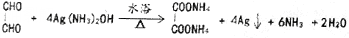 .
.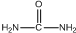 )和甲醇在催化剂、加热条件下,发生取代反应生成DMC,请写出该反应的化学反应方程式
)和甲醇在催化剂、加热条件下,发生取代反应生成DMC,请写出该反应的化学反应方程式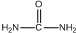 +2CH3OH$→_{△}^{催化剂}$
+2CH3OH$→_{△}^{催化剂}$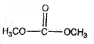 +2NH3↑.
+2NH3↑.