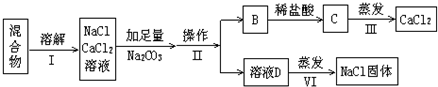
题目内容
工业上冶炼冰铜(mCu2O?nFeS)可得到粗铜,再以粗铜为原料制备硫酸铜晶体.
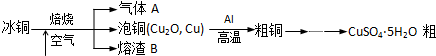
完成下列填空:
(1)气体A中的大气污染物可选用下列试剂中的 (填序号)吸收.
a.浓H2SO4 b.浓HNO3 c.NaOH溶液 d.氨水
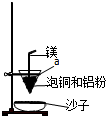
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加 (填物质名称)溶液后呈红色,说明溶液中存在Fe3+,检验溶液中还存在Fe2+的方法是 (注明试剂、现象).实验室可用如图的装置完成泡铜冶炼粗铜的反应.
(3)泡铜冶炼粗铜的化学方程式是 .
(4)装置中镁带的作用是 .泡铜和铝粉混合物表面覆盖少量白色固体a,a是 (填名称).沙子能否换成水? (填“能”或“不能”).

完成下列填空:
(1)气体A中的大气污染物可选用下列试剂中的
a.浓H2SO4 b.浓HNO3 c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加

(3)泡铜冶炼粗铜的化学方程式是
(4)装置中镁带的作用是
考点:物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计
专题:实验设计题
分析:冰铜焙烧得到二氧化硫、泡铜和铁的氧化物,泡铜通过铝热反应得到粗铜,粗铜经过一系列变化得到硫酸铜晶体.
(1)气体A为SO2,可用碱液吸收;
(2)检验溶液中存在Fe3+,可用KSCN,Fe2+具有还原性,可用酸性高锰酸钾溶液检验;
(3)Cu2O与Al在高温下反应生成Cu和Al2O3,为铝热反应;
(4)镁带起到引燃作用,用氯酸钾作助燃剂,生成氧气,有利于镁的燃烧;为防止坠落的高温液体炸裂蒸发皿,蒸发皿内要垫上沙子.
(1)气体A为SO2,可用碱液吸收;
(2)检验溶液中存在Fe3+,可用KSCN,Fe2+具有还原性,可用酸性高锰酸钾溶液检验;
(3)Cu2O与Al在高温下反应生成Cu和Al2O3,为铝热反应;
(4)镁带起到引燃作用,用氯酸钾作助燃剂,生成氧气,有利于镁的燃烧;为防止坠落的高温液体炸裂蒸发皿,蒸发皿内要垫上沙子.
解答:
解:(1)气体A为SO2,可用碱液吸收,则应用NaOH或氨水,故答案为:cd;
(2)检验溶液中存在Fe3+,可用KSCN,溶液变成红色,Fe2+具有还原性,可用酸性高锰酸钾溶液检验,操作为另取少量溶液,滴加几滴高锰酸钾的酸性溶液,紫色褪去,说明溶液中存在Fe2+,
故答案为:硫氰化钾;另取少量溶液,滴加几滴高锰酸钾的酸性溶液,紫色褪去,说明溶液中存在Fe2+;
(3)Cu2O与Al在高温下反应生成Cu和Al2O3,反应的方程式为3Cu2O+2Al
6Cu+Al2O3,故答案为:3Cu2O+2Al
6Cu+Al2O3;
(4)镁带起到引燃作用,用氯酸钾作助燃剂,生成氧气,有利于镁的燃烧,为防止坠落的高温液体炸裂蒸发皿,蒸发皿内要垫上沙子,不能用水,不能保护蒸发皿不被炸裂,
故答案为:燃烧放出大量的热,创造高温环境(或引燃剂);氯酸钾;不能.
(2)检验溶液中存在Fe3+,可用KSCN,溶液变成红色,Fe2+具有还原性,可用酸性高锰酸钾溶液检验,操作为另取少量溶液,滴加几滴高锰酸钾的酸性溶液,紫色褪去,说明溶液中存在Fe2+,
故答案为:硫氰化钾;另取少量溶液,滴加几滴高锰酸钾的酸性溶液,紫色褪去,说明溶液中存在Fe2+;
(3)Cu2O与Al在高温下反应生成Cu和Al2O3,反应的方程式为3Cu2O+2Al
| ||
| ||
(4)镁带起到引燃作用,用氯酸钾作助燃剂,生成氧气,有利于镁的燃烧,为防止坠落的高温液体炸裂蒸发皿,蒸发皿内要垫上沙子,不能用水,不能保护蒸发皿不被炸裂,
故答案为:燃烧放出大量的热,创造高温环境(或引燃剂);氯酸钾;不能.
点评:本题综合考查制备实验,涉及物质的分离提纯及检验知识,侧重于综合考查学生的实验能力,注意把握实验原理和实验方法,题目难度中等.

练习册系列答案
相关题目
一定量某营养液中溶质的配方分别如下:对于两种营养液的成分,下列说法中正确的是( )
配方一:0.2mol KCl,0.1mol K2SO4,0.3molZnSO4
配方二:0.1mol KCl,0.3mol K2SO4,0.1molZnCl2.
配方一:0.2mol KCl,0.1mol K2SO4,0.3molZnSO4
配方二:0.1mol KCl,0.3mol K2SO4,0.1molZnCl2.
| A、只有n (K+)相同 |
| B、只有n (Cl-)相同 |
| C、各离子的物质的量完全相同 |
| D、各离子的物质的量完全不同 |
将4.34gNa、Na2O、Na2O2的混合物与足量的水反应,在标准状况下得到672mL混合气体.该混合气体通过电火花引燃,恰好完全反应,则混合物中Na、Na2O和Na2O2的物质的量之比为( )
| A、1:1:1 |
| B、1:1:2 |
| C、1:2:2 |
| D、4:3:2 |
 已知:A是石油裂解气的主要成份.A的产量通常用来衡量一个国家的石油化工水平,现以A为主要原料合成乙酸乙酯,其合成路线如图所示.
已知:A是石油裂解气的主要成份.A的产量通常用来衡量一个国家的石油化工水平,现以A为主要原料合成乙酸乙酯,其合成路线如图所示.