题目内容
1.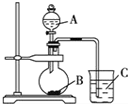 某研究性学习小组设计了一组实验验证非金属元素的非金属性越强,对应的最高价含氧酸的酸性就越强.他们设计了如图装置以验证 氮、碳、硅元素的非金属性强弱.他们设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到有白色沉淀生成.
某研究性学习小组设计了一组实验验证非金属元素的非金属性越强,对应的最高价含氧酸的酸性就越强.他们设计了如图装置以验证 氮、碳、硅元素的非金属性强弱.他们设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到有白色沉淀生成.写出所选用物质的化学式:A:HNO3 B:CaCO3C:Na2SiO3.
分析 验证 氮、碳、硅元素的非金属性强弱,利用强酸制备弱酸进行,A是强酸;B是块状固体,打开分液漏斗的活塞后,C中可观察到白色沉淀生成,则B为碳酸钙、C为硅酸钠,据此解答.
解答 解:验证 氮、碳、硅元素的非金属性强弱,由最高价氧化物的水化物的酸性越强,其元素的非金属性越强,利用强酸制备弱酸进行,A是强酸,常温下可与铜反应,硝酸;B是块状固体,打开分液漏斗的活塞后,C中可观察到白色沉淀生成,则B为碳酸钙、C为硅酸钠,
故答案为:HNO3;CaCO3;C:Na2SiO3.
点评 本题将元素及其化合物、元素周期律与实验知识结合起来,考查了审题能力、思维能力,具有较强的综合性,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
12. 为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想如图所示.下列说法不正确的是( )
为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想如图所示.下列说法不正确的是( )
 为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想如图所示.下列说法不正确的是( )
为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想如图所示.下列说法不正确的是( )| A. | H2O的分解反应是吸热反应 | |
| B. | 过程①是太阳能转换成化学能 | |
| C. | 过程②是化学能转换为电能 | |
| D. | 氢气不易贮存和运输,无开发利用价值 |
9.下列各组顺序的排列不正确的是( )
| A. | 热稳定性:HCl>H2S>PH3 | B. | 酸性强弱:H4SiO4<H2CO3<HNO3 | ||
| C. | 金属性:Na<Mg<Al | D. | 沸点:H2O>H2S |
16. 碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列说法是正确的是( )
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列说法是正确的是( )
 碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列说法是正确的是( )
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列说法是正确的是( )| A. | 洗气瓶中产生的沉淀是碳酸钡 | |
| B. | 从Z导管出来的气体中无二氧化碳 | |
| C. | 洗气瓶中产生的沉淀是碳酸钡和硫酸钡的混合物 | |
| D. | 在导管中有红棕色气体出现 |
13.化学键使得一百多种元素构成了世界的万事万物.关于化学键的下 列叙述中正确的是( )
| A. | 离子化合物可能含共价键,共价化合物中可能含离子键 | |
| B. | 碘易升华是因为分子间的共价键较弱 | |
| C. | 构成单质分子的微粒一定含有化学键 | |
| D. | 在氧化钠中,除氧离子和钠离子的静电吸引作用外,还存在电子与电子、原子核与原子核之间的排斥作用 |
10.六种短周期元素A、B、C、D、E、F的原子序数依次增大,其中A与E同主族,B与F同主族,E与F同周期.已知A与其他元素不在同一周期,D的核电荷数是B的最外层电子数的2倍,单质F是一种重要的半导体材料.则下列推断中正确的是( )
| A. | A、B两种元素可组成化学式为BA4的化合物 | |
| B. | F与D形成的化合物性质很不活泼,不与任何酸反应 | |
| C. | 原子半径由大到小的顺序是C>B | |
| D. | 气态氢化物的稳定性由强到弱的顺序是C>D |
15.某学习小组对影响速率的因素和氧化还原反应滴定进行探究:
探究I“影响化学反应速率的因素”,选用4mL0.01mol/LKMn04溶液与2mL0.1mol/L H2C2O4溶液在稀硫酸中进行实验,改变条件如表:
(1)实验①和②的目的是研究催化剂对化学反应速率的影响;如果研究温度对化学反应速率的影响,使用实验①和③.
(2)对比实验①和④,可以研究反应物的浓度对化学反应速率的影响,实验④中加入1mL蒸馏水的目的是确保①和④组对比实验中c(KMnO4)或确保溶液总体积不变.
探究II.该小组查阅资料得知:2Mn04-+5C2042-+16H+═2Mn2++10CO2↑+8H2O,欲利用该反应测定某草酸钠(Na2C204)样品中草酸钠的质量分数.该小组称量1.34g草酸钠样品溶于稀硫酸中,然后用0.200mol/L的酸性高键酸钾溶液进行滴定(其中的杂质不跟高锰酸钾和稀硫酸反应).
(1)滴定前是否要滴加指示剂?否.(填“是”或“否”)
(2)下列操作中可能使所测Na2C204溶液的浓度数值偏低的是
A.酸式滴定管未用标准酸性高锰酸钾溶液润洗就直接注入酸性高锰酸钾溶液
B.滴定前盛放Na2C204溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取酸性高锰酸钾溶液体积时,开始仰视读数,滴定结束时俯视读数
(3)达到终点时消耗了15.00mL的高锰酸钾溶液,样品中草酸钠的质量分数为75%.
探究I“影响化学反应速率的因素”,选用4mL0.01mol/LKMn04溶液与2mL0.1mol/L H2C2O4溶液在稀硫酸中进行实验,改变条件如表:
| 组别 | 草酸的体积(mL) | 温度 | 其他物质 |
| ① | 2Ml | 20 | 无 |
| ② | 2mL | 20 | 10滴饱和MnS04溶液 |
| ③ | 2mL | 30 | 无 |
| ④ | 1mL | 20 | 1mL蒸馈水 |
(2)对比实验①和④,可以研究反应物的浓度对化学反应速率的影响,实验④中加入1mL蒸馏水的目的是确保①和④组对比实验中c(KMnO4)或确保溶液总体积不变.
探究II.该小组查阅资料得知:2Mn04-+5C2042-+16H+═2Mn2++10CO2↑+8H2O,欲利用该反应测定某草酸钠(Na2C204)样品中草酸钠的质量分数.该小组称量1.34g草酸钠样品溶于稀硫酸中,然后用0.200mol/L的酸性高键酸钾溶液进行滴定(其中的杂质不跟高锰酸钾和稀硫酸反应).
(1)滴定前是否要滴加指示剂?否.(填“是”或“否”)
(2)下列操作中可能使所测Na2C204溶液的浓度数值偏低的是
A.酸式滴定管未用标准酸性高锰酸钾溶液润洗就直接注入酸性高锰酸钾溶液
B.滴定前盛放Na2C204溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取酸性高锰酸钾溶液体积时,开始仰视读数,滴定结束时俯视读数
(3)达到终点时消耗了15.00mL的高锰酸钾溶液,样品中草酸钠的质量分数为75%.
 CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值的化学品是目前的研究方向.
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值的化学品是目前的研究方向.