题目内容
许多尾气中含有NOX、SO2等造成空气污染的气体.根据要求回答下列问题:
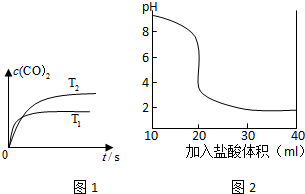
(1)已知:NO2(g)+CO (g)═CO2 (g)+NO (g).
①密闭容器中发生该反应时,c(CO2)随温度(T)变化曲线如图1所示.据此判断,升高温度,该反应的平衡常数 (选填“增大”、“减小”“不变”).
②NO对臭氧层破坏会起催化作用,其主要过程为:
Ⅰ.O3
O+O2
Ⅱ.NO+O3→NO2+O2
Ⅲ. .(请写出“Ⅲ”中的化学反应方程式.)
(2)将CO2和H2合成二甲醚(CH3OCH3)已取得了较大的进展,其化学反应为:2CO2(g)+6H2(g)═CH3OCH3(g)+3H2O(g)
①1g二甲醚气体完全燃烧生成两种气态氧化物,放出能量q kJ,请写出该反应的热化学方程式 ;
②二甲醚可以作为燃料电池的燃料,若用硫酸做电池中的电解质溶液,请写出该燃料电池工作时负极电极反应式 .
(3)室温条件下,用0.10mol?L-1盐酸分别滴定20.00mL浓度均为0.10mol?L-1的NaOH溶液和氨水,如图2是滴定其中一种溶液时,所得混合液的pH与加入盐酸体积的关系曲线图.
①该曲线表示滴定 (填“NaOH”或“氨水”)的过程;
②当向20.00mL NaOH溶液中加入v mL盐酸时,所得混合溶液pH=12,则v= .(保留2位小数).

(1)已知:NO2(g)+CO (g)═CO2 (g)+NO (g).
①密闭容器中发生该反应时,c(CO2)随温度(T)变化曲线如图1所示.据此判断,升高温度,该反应的平衡常数
②NO对臭氧层破坏会起催化作用,其主要过程为:
Ⅰ.O3
| ||
Ⅱ.NO+O3→NO2+O2
Ⅲ.
(2)将CO2和H2合成二甲醚(CH3OCH3)已取得了较大的进展,其化学反应为:2CO2(g)+6H2(g)═CH3OCH3(g)+3H2O(g)
①1g二甲醚气体完全燃烧生成两种气态氧化物,放出能量q kJ,请写出该反应的热化学方程式
②二甲醚可以作为燃料电池的燃料,若用硫酸做电池中的电解质溶液,请写出该燃料电池工作时负极电极反应式
(3)室温条件下,用0.10mol?L-1盐酸分别滴定20.00mL浓度均为0.10mol?L-1的NaOH溶液和氨水,如图2是滴定其中一种溶液时,所得混合液的pH与加入盐酸体积的关系曲线图.
①该曲线表示滴定
②当向20.00mL NaOH溶液中加入v mL盐酸时,所得混合溶液pH=12,则v=
考点:常见的生活环境的污染及治理,化学电源新型电池,化学平衡的影响因素,酸碱混合时的定性判断及有关ph的计算
专题:
分析:(1)①根据到达平衡的时间判断温度高低,根据平衡时二氧化碳的浓度判断温度对平衡的影响;
②根据催化剂在反应前后质量和化学性质不变来分析书写;
(2)①根据书写热化学方程式的方法来书写;
②根据燃料电池为燃料作负极失电子发生氧化反应,结合电解质溶液书写负极电极反应式;
(3)①根据NaOH和氨水在滴定开始时的pH来判断;
②根据混合后pH=12显碱性列方程求解.
②根据催化剂在反应前后质量和化学性质不变来分析书写;
(2)①根据书写热化学方程式的方法来书写;
②根据燃料电池为燃料作负极失电子发生氧化反应,结合电解质溶液书写负极电极反应式;
(3)①根据NaOH和氨水在滴定开始时的pH来判断;
②根据混合后pH=12显碱性列方程求解.
解答:
解:(1)①由图1可知,温度T1先到达平衡,故温度T1>T2,温度越高平衡时,二氧化碳的浓度越低,说明升高温度平衡向逆反应移动,故反应的平衡常数减小,
故答案为:减小;
②由催化剂在反应前后质量和化学性质不变,所以反应Ⅲ为Ⅰ-Ⅱ得NO2═NO+O,故答案为:NO2═NO+O;
(2)1g二甲醚气体完全燃烧生成两种气态氧化物,放出能量q kJ,则46克二甲醚(CH3OCH3,液态)完全燃烧生成CO2和气态H2O时放出qkJ×46=46qkJ的热量,热化学方程式为CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(g),△H=-46qkJ/mol,
故答案为:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(g),△H=-46qkJ/mol;
②燃料电池为燃料作负极失电子发生氧化反应,又电解质溶液为硫酸,所以负极电极反应式为CH3OCH3+3H2O-12e-=2CO2↑+12H+,
故答案为:CH3OCH3+3H2O-12e-=2CO2↑+12H+;
(3)①滴定开始时0.10mol?L-1的NaOH溶液pH=13,0.10mol?L-1的氨水溶液pH<13,所以该曲线表示滴定氨水,故答案为:氨水;
②当向20.00mL NaOH溶液中加入v mL盐酸时,所得混合溶液pH=12,则有10-2=
,解得V=16.36ml,故答案为:16.36ml.
故答案为:减小;
②由催化剂在反应前后质量和化学性质不变,所以反应Ⅲ为Ⅰ-Ⅱ得NO2═NO+O,故答案为:NO2═NO+O;
(2)1g二甲醚气体完全燃烧生成两种气态氧化物,放出能量q kJ,则46克二甲醚(CH3OCH3,液态)完全燃烧生成CO2和气态H2O时放出qkJ×46=46qkJ的热量,热化学方程式为CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(g),△H=-46qkJ/mol,
故答案为:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(g),△H=-46qkJ/mol;
②燃料电池为燃料作负极失电子发生氧化反应,又电解质溶液为硫酸,所以负极电极反应式为CH3OCH3+3H2O-12e-=2CO2↑+12H+,
故答案为:CH3OCH3+3H2O-12e-=2CO2↑+12H+;
(3)①滴定开始时0.10mol?L-1的NaOH溶液pH=13,0.10mol?L-1的氨水溶液pH<13,所以该曲线表示滴定氨水,故答案为:氨水;
②当向20.00mL NaOH溶液中加入v mL盐酸时,所得混合溶液pH=12,则有10-2=
| 0.02×0.10-0.10V×10 -3 |
| 0.2+10 -3V |
点评:本题考查了平衡移动、热化学方程式的书写,燃料电池负极反应式的书写及溶液pH的简单计算等,比较综合,题目难度中等.

练习册系列答案
相关题目
下列说法正确的是( )
| A、铅蓄电池在放电过程中,负极质量增加,正极质量减少 |
| B、0.1mol?L-1NH4Cl和0.1mol?L-1NH3?H2O等体积混合后离子浓度关系:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| C、在轮船水线以下的船体装上一定数量的锌块可以保护轮船 |
| D、锅炉中沉积的CaSO4可直接用稀盐酸溶解除去 |
下列除去杂质(括号内的物质是杂质)时,选用的试剂或方法正确的是( )
| A | B | C | D | |
| 试样 | NaCl溶液(Na2CO3) | NaCl固体(I2) | CO2(SO2) | NaHCO3溶液(Na2CO3) |
| 除杂试剂 或方法 | 澄清石灰水 | 加热 | NaOH溶液 | 加热 |
| A、A | B、B | C、C | D、D |
下列四种化合物:①碳酸氢钠 ②氯化铵 ③偏铝酸钠 ④氢氧化铝,既能跟盐酸反应,又能跟氢氧化钠溶液反应的是( )
| A、① | B、②③ | C、②③④ | D、①④ |
以下变化是熵减小过程的是( )
| A、碳酸氢钠受热分解 |
| B、氨气与氯化氢气体反应 |
| C、高温下用焦炭制水煤气 |
| D、液态水气化 |
下列有关概念间关系的说法正确的是( )
| A、碱性氧化物一定是金属氧化物 |
| B、氧化剂在化学反应中一定被氧化 |
| C、某原子的质量数也就是它的相对原子质量 |
| D、摩尔质量相同的物质其摩尔体积一定相同 |
下列关于金属铝的叙述中,说法正确的是( )
| A、Al 是地壳中含量最多的元素 |
| B、Al 是比较活泼的金属,在化学反应中容易失去电子,表现氧化性 |
| C、Al箔在空气中受热可以熔化,且发生剧烈燃烧 |
| D、Al箔在空气中受热可以熔化,由于氧化膜的存在,熔化的Al 并不滴落 |
