题目内容
下列说法正确的是( )
| A、铅蓄电池在放电过程中,负极质量增加,正极质量减少 |
| B、0.1mol?L-1NH4Cl和0.1mol?L-1NH3?H2O等体积混合后离子浓度关系:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| C、在轮船水线以下的船体装上一定数量的锌块可以保护轮船 |
| D、锅炉中沉积的CaSO4可直接用稀盐酸溶解除去 |
考点:常见化学电源的种类及其工作原理,金属的电化学腐蚀与防护,盐类水解的应用,难溶电解质的溶解平衡及沉淀转化的本质
专题:盐类的水解专题,电化学专题
分析:A、根据铅蓄电池的工作原理来回答;
B、0.1mol?L-1 NH4Cl和0.1mol?L-1 NH3?H2O溶液中,氨水电离出的铵离子大于溶液中铵离子的水解,铵离子浓度大于0.1mol?L-1;
C、作原电池正极的金属被保护;
D、CaSO4不与稀盐酸反应.
B、0.1mol?L-1 NH4Cl和0.1mol?L-1 NH3?H2O溶液中,氨水电离出的铵离子大于溶液中铵离子的水解,铵离子浓度大于0.1mol?L-1;
C、作原电池正极的金属被保护;
D、CaSO4不与稀盐酸反应.
解答:
解:A、铅蓄电池工作时,负极是金属铅失电子,正极上是二氧化铅得电子,都是生成硫酸铅,质量增加,故A错误;
B、0.1mol?L-1 NH4Cl和0.1mol?L-1 NH3?H2O溶液中,氨水电离出的铵离子大于溶液中铵离子的水解,铵离子浓度大于0.1mol?L-1,即(Cl-)<c(NH4+),故B错误;
C、锌、铁和海水构成原电池,锌易失电子作负极,Fe作正极,正极上得电子发生还原反应,则Fe被保护,故C正确;
D、CaSO4不与稀盐酸反应,故D错误,故选C.
B、0.1mol?L-1 NH4Cl和0.1mol?L-1 NH3?H2O溶液中,氨水电离出的铵离子大于溶液中铵离子的水解,铵离子浓度大于0.1mol?L-1,即(Cl-)<c(NH4+),故B错误;
C、锌、铁和海水构成原电池,锌易失电子作负极,Fe作正极,正极上得电子发生还原反应,则Fe被保护,故C正确;
D、CaSO4不与稀盐酸反应,故D错误,故选C.
点评:本题考查较为综合,涉及原电池、盐类水解、沉淀溶解平衡等,为高考常见题型,侧重于学生的分析能力和基础知识的综合理解和运用的考查,难度不大,注意相关知识的积累.

练习册系列答案
相关题目
下列比较中,正确的是( )
| A、原子半径:Na>Mg |
| B、碱性:NaOH>KOH |
| C、结合H+的能力:CO32-<Cl- |
| D、还原性:I-<Br- |
下列物质中的杂质(括号内为杂质),不能用在空气中加热的方法除去的是( )
| A、Na2O2(Na2O) |
| B、KCl(KClO3) |
| C、Na2CO3(NaHCO3) |
| D、NH4Cl(I2) |
刚装修好的房子须通风换气一段时间后方可入住,其原因是装修材料会挥发出一些有毒物质,这些物质可能是( )
| A、甲醛 | B、苯 |
| C、甲苯 | D、CO2 |


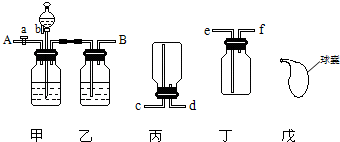 利用如图装置可以从CO、CO2的混合气体中先后分离出干燥的CO和CO2气体.
利用如图装置可以从CO、CO2的混合气体中先后分离出干燥的CO和CO2气体.