题目内容
2.己知反应A(g)+B(g)?C(g)+D(g)的平衡常数K值与温度的关系如表所示.830℃时,向一个2L的密闭容器中充入0.20molA和0.80molB,4s内v(A)=0.005mol•L-1•S-1.下列说法正确的是( )| 温度/℃ | 700 | 830 | 1200 |
| K值 | 1.7 | 1.0 | 0.4 |
| A. | 4s时,c(B)为0.76 mol•L-1 | |
| B. | 830℃到平衡时,A的转化率为80% | |
| C. | 达平衡时,升高温度,平衡正向移动 | |
| D. | 1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数的值为0.4 |
分析 A.反应初始4s内A的平均反应速率v(A)=0.005mol/(L•s),则参加反应的A为0.005mol/(L•s)×4s=0.02molL,结合反应可知参加反应的B为0.02mol/L;
B.830℃达平衡时,K=1.0,设转化的A为x,则
浓度 A(g)+B(g)?C(g)+D(g)
开始 0.1 0.4 0 0
转化 x x x x
平衡 0.1-x 0.4-x x x
则$\frac{x×x}{(0.1-x)(0.4-x)}$=1,解得x=0.08mol/L;
C.由表格数据可知,温度越高,K越小;
D.相同温度下,相反过程的K互为倒数.
解答 解:A.反应初始4s内A的平均反应速率v(A)=0.005mol/(L•s),则参加反应的A为0.005mol/(L•s)×4s=0.02molL,结合反应可知参加反应的B为0.02mol/L,则4 s时c(B)为$\frac{0.8mol}{2L}$-0.02mol/L=0.38 mol/L,故A错误;
B.830℃达平衡时,K=1.0,设转化的A为x,则
浓度 A(g)+B(g)?C(g)+D(g)
开始 0.1 0.4 0 0
转化 x x x x
平衡 0.1-x 0.4-x x x
则$\frac{x×x}{(0.1-x)(0.4-x)}$=1,解得x=0.08mol/L,则A的转化率为$\frac{0.08mol/L}{0.1mol/L}$×100%=80%,故B正确;
C.由表格数据可知,温度越高,K越小,正反应为放热反应,则升高温度,平衡逆向移动,故C错误;
D.相同温度下,相反过程的K互为倒数,由1200℃时A(g)+B(g)?C(g)+D(g)的K=0.4,则1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数为$\frac{1}{0.4}$=2.5,故D错误;
故选B.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、转化率及速率计算、K的计算等为解答的关键,侧重分析与计算能力的考查,注意表格数据的应用,题目难度不大.

 口算能手系列答案
口算能手系列答案| A. | 氯酸钾是还原剂 | |
| B. | KCl既是氧化产物,又是还原产物 | |
| C. | 反应中消耗3mol P时,转移电子的物质的量为15mol | |
| D. | 发令时产生的白烟只是KCl固体颗粒 |
| A. | 56gFe与足量的盐酸反应,转移的电子数为2NA | |
| B. | 标准状况下,22.4L的水中含有的原子数为3NA | |
| C. | 物质的量浓度为2mol/L的BaCl2溶液中,含有Cl-个数为4NA | |
| D. | 22.4 L CO和CO2的混合气体中所含的碳原子数一定是NA |
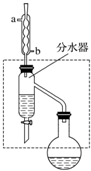 乙酸丁酯是重要的化工原料,具有水果香味.实验室制备乙酸丁酯的反应、装置示意图和有关信息如下:
乙酸丁酯是重要的化工原料,具有水果香味.实验室制备乙酸丁酯的反应、装置示意图和有关信息如下:CH3COOH+CH3CH2CH2CH2OH$?_{浓H_{2}SO_{4}}^{△}$ CH3COOCH2CH2CH2CH3+H2O
| 乙酸 | 正丁醇 | 乙酸丁酯 | |
| 熔点/℃ | 16.6 | -89.5 | -73.5 |
| 沸点/℃ | 117.9 | 117 | 126.0 |
| 密度/g•cm-3 | 1.1 | 0.80 | 0.88 |
在干燥的50mL圆底烧瓶中,装入沸石,加入12.0mL正丁醇和16.0mL冰醋酸(过量),再加3~4滴浓硫酸.然后再安装分水器(作用:实验过程中不断分离除去反应生成的水)、冷凝管,然后小火加热.将烧瓶中反应后的混合物冷却与分水器的酯层合并.装置中冷水应从b(填“a”或“b”)口通入;通过分水器不断分离除去反应生成的水的目的是分离生成的水,使平衡正向移动,提高反应产率.
(2)乙酸丁酯的精制
将乙酸丁酯粗产品用如下的操作进行精制:①水洗、②蒸馏、③用无水MgSO4干燥、④用10%碳酸钠洗涤.
①正确的操作步骤是c(填标号).
A.①②③④B.③①④②C.④①③②D.③④①②
②在乙酸丁酯的精制中,用10%碳酸钠洗涤的主要目的是除去产品中含有的乙酸、硫酸等杂质.
③在洗涤、分液操作中,应充分振荡,然后静置,待分层后d(填标号).
a.直接将乙酸丁酯从分液漏斗的上口倒出
b.直接将乙酸丁酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸丁酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸丁酯从上口倒出
(3)计算产率
测量分水器内由乙酸与丁醇反应生成的水体积为1.8mL,假设在制取乙酸丁酯过程中反应物和生成物没有损失,且忽略副反应,乙酸丁酯的产率为77.1%.
| A. |  由如图知,石墨转变为金刚石是放热反应 | |
| B. |  由如图知,S(g)+O2(g)═SO2(g)△H1,S(s)+O2(g)═SO2(g)△H2则△H1<△H2 | |
| C. |  由如图知,白磷比红磷稳定 | |
| D. |  如由图知,CO(g)+H2O(g)═CO2(g)+H2(g)△H>0 |
| A. | CuO是还原剂,被氧化 | |
| B. | H2是还原剂,被氧化 | |
| C. | H2O既不是氧化产物也不是还原产物 | |
| D. | Cu是还原产物,被还原 |