题目内容
11.硫酸亚铁晶体(FeSO4•7H2O)在医药上做补血剂,聚合硫酸铁[Fe2(OH)n(SO4)(3-$\frac{n}{2}$)]m是高效的水处理混凝剂,在实验窒以铁屑和稀硫酸为主要原料.制备它们的实验方案如下;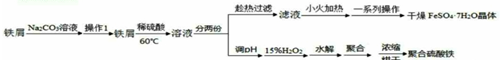
已知:所得聚合硫酸铁产品若能用于饮用水处理.需达到盐基度指际在8.0%~16.0%范围内.盐基度是指产品中n(OH-)、n(Fe3+) 的比值,即盐基度=n(OH-)/n(Fe3+)×100%
(1)操作1的名称是过滤.
(2)聚合硫酸铁的盐基度的测定:
①称取a g聚合硫酸铁产品溶于足量的盐酸中,溶液均分两等份.
②向一份中加入足量的铜片,充分反应后铜片减轻4.48g.
③向另一份中滴加足量的BaCl2溶液,得到干燥的沉淀46.6g.
则该产品的盐基度为14.3%(保留三位有效数字).
分析 铁屑在碳酸钠溶液中除去表面的油脂,过滤后得到铁屑加入稀硫酸加热反应得到溶液分为两份,趁热过滤得到滤液小火加热蒸发浓缩、冷却结晶、过滤洗涤、干燥得到硫酸亚铁晶体,另一份调节溶液PH,加入过氧化氢溶液氧化亚铁离子生成铁离子,水解聚合浓缩烘干得到聚合硫酸铁,
(1)操作1为过滤操作;
(2)盐基度是指产品中n(OH-)、n(Fe3+) 的比值,即盐基度=n(OH-)/n(Fe3+)×100%,称取a g聚合硫酸铁产品溶于足量的盐酸中,溶液均分两等份,向一份中加入足量的铜片,充分反应后铜片减轻4.48g.是铁离子和铜反应,据此计算铁离子物质的量,向另一份中滴加足量的BaCl2溶液,得到干燥的沉淀46.6g,沉淀为硫酸钡,计算物质的量得到硫酸根离子物质的量,聚合电荷守恒计算氢氧根离子物质的量,计算得到盐基度.
解答 解:铁屑在碳酸钠溶液中除去表面的油脂,过滤后得到铁屑加入稀硫酸加热反应得到溶液分为两份,趁热过滤得到滤液小火加热蒸发浓缩、冷却结晶、过滤洗涤、干燥得到硫酸亚铁晶体,另一份调节溶液PH,加入过氧化氢溶液氧化亚铁离子生成铁离子,水解聚合浓缩烘干得到聚合硫酸铁,
(1)上述分析可知,操作1为过滤操作,故答案为:过滤;
(2)盐基度是指产品中n(OH-)、n(Fe3+) 的比值,即盐基度=n(OH-)/n(Fe3+)×100%,称取a g聚合硫酸铁产品溶于足量的盐酸中,溶液均分两等份,向一份中加入足量的铜片,充分反应后铜片减轻4.48g,n(Cu)=$\frac{4.48g}{64g/mol}$=0.07mol,是铁离子和铜反应,2Fe3++Cu=2Fe2++Cu2+,据此计算铁离子物质的量=0.14mol,原ag产品中含铁离子为0.28mol,向另一份中滴加足量的BaCl2溶液,得到干燥的沉淀46.6g,沉淀为硫酸钡,物质的量n(BaSO4)=$\frac{46.6g}{233g/mol}$=0.2mol,原ag产品中硫酸根离子物质的量为0.4mol,结合电荷守恒计算氢氧根离子物质的量,n(OH-)=3n(Fe3+)-2n(SO42-)=3×0.14mol-2×0.4mol=0.04mol,计算得到盐基度=$\frac{0.04mol}{0.28mol}$×100%=14.3%,
故答案为:14.3%.
点评 本题考查了物质分离提纯、物质性质和流程分析,离子性质和反应现象的判断,注意题干信息的应用,掌握基础是解题关键,题目难度中等.

| A. | H218O 的摩尔质量为20g?mol-1 | |
| B. | 铁粉溶于盐酸的化学方程式:2Fe+6HCl=2FeCl3+3H2↑ | |
| C. | 氯离子的结构示意图: | |
| D. | 乙醇的分子式为CH3CH2OH |
| 温度/℃ | 700 | 830 | 1200 |
| K值 | 1.7 | 1.0 | 0.4 |
| A. | 4s时,c(B)为0.76 mol•L-1 | |
| B. | 830℃到平衡时,A的转化率为80% | |
| C. | 达平衡时,升高温度,平衡正向移动 | |
| D. | 1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数的值为0.4 |
| A. | 升高温度,W 的体积分数减小,△H 增大 | |
| B. | 以 Y 的浓度变化表示的反应速率为 0.01 mol/(L•s) | |
| C. | 在其它条件不变的情况下,增加 1 mol X,则 X 和 Y 的转化率均提高 | |
| D. | 再向容器中通入 2 mol X 和 1 mol Y,达到平衡时,X、Y 的转化率均增大 |
| A. | Al2O3 | B. | MgO | C. | SiO2 | D. | Fe2O3 |
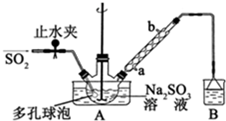
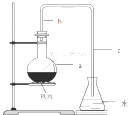 中学实验室用如图所示装置制取少量溴苯.请填写下列空白.
中学实验室用如图所示装置制取少量溴苯.请填写下列空白.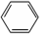 +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$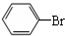 +HBr.
+HBr.