题目内容
9.下列离子方程式书写正确的是( )| A. | 醋酸钡与硫酸反应:Ba2++SO42-→BaSO4↓ | |
| B. | 金属铝溶于稀硫酸:Al+2H+→Al3++H2↓ | |
| C. | 将氯气溶于水制备次氯酸:Cl2+H2O→2H++Cl-+ClO- | |
| D. | 碳酸氢钠和盐酸反应:HCO3-+H+→CO2↑+H2O |
分析 A.二者反应生成硫酸钡和醋酸,漏掉醋酸根离子与氢离子的反应;
B.电荷不守恒;
C.次氯酸为弱酸,应保留化学式;
D.二者反应生成而二氧化碳和氯化钠和水;
解答 解:A.醋酸钡与硫酸反应,离子方程式:2CH3COO-+2H++Ba2++SO42-→BaSO4↓+2CH3COOH,故A错误;
B.金属铝溶于稀硫酸,离子方程式:2Al+6H+→2Al3++3H2↓,故B错误;
C.将氯气溶于水制备次氯酸,离子方程式:Cl2+H2O→H++Cl-+HClO,故C错误;
D.碳酸氢钠和盐酸反应,离子方程式:HCO3-+H+→CO2↑+H2O,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,侧重考查复分解反应的离子方程式书写,明确反应实质及离子方程式书写方法是解题关键,注意离子反应遵循客观事实、遵循电荷守恒规律.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.下列电离方程式正确的是( )
| A. | H2S?2H++S2- | B. | NaHSO4?Na ++HSO4- | ||
| C. | NaHCO3?Na++H++CO32- | D. | HCO3-?CO32-+H+ |
18.化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为H2(g)和Cl2(g)反应生成HCl (g)过程中的能量变化:
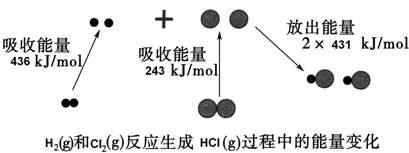
下列说法中正确的是( )

下列说法中正确的是( )
| A. | 1 mol H2(g)和1 mol Cl2(g)具有的总能量大于2 mol HCl(g)具有的总能量 | |
| B. | 该反应的△H>0 | |
| C. | 通常情况下,H2(g)和Cl2(g)混合容易直接生成HCl(g) | |
| D. | 生成的HCl溶于水会发生电离,即HCl=H++Cl-,由此判断,HCl中存在离子键 |
14. 为实现2008北京“科技奥运”战略,我国兴奋剂检测生物芯片装置已定型和批量生产,可快捷检测常见的16种兴奋剂.已知某兴奋剂乙基雌烯醇(etylestrenol)的结构如图所示.下列叙述中不正确的是( )
为实现2008北京“科技奥运”战略,我国兴奋剂检测生物芯片装置已定型和批量生产,可快捷检测常见的16种兴奋剂.已知某兴奋剂乙基雌烯醇(etylestrenol)的结构如图所示.下列叙述中不正确的是( )
 为实现2008北京“科技奥运”战略,我国兴奋剂检测生物芯片装置已定型和批量生产,可快捷检测常见的16种兴奋剂.已知某兴奋剂乙基雌烯醇(etylestrenol)的结构如图所示.下列叙述中不正确的是( )
为实现2008北京“科技奥运”战略,我国兴奋剂检测生物芯片装置已定型和批量生产,可快捷检测常见的16种兴奋剂.已知某兴奋剂乙基雌烯醇(etylestrenol)的结构如图所示.下列叙述中不正确的是( )| A. | 该物质可以视为醇类 | |
| B. | 不能使溴的四氯化碳溶液褪色,但可以使酸性的高锰酸钾溶液褪色 | |
| C. | 在浓硫酸作用下,分子内消去一个水分子,产物有两种同分异构体 | |
| D. | 该物质分子中的所有碳原子不可能共面 |
1.下列反应为吸热反应的是( )
| A. | 镁条与盐酸反应 | B. | 甲烷的燃烧 | C. | 硫酸与氢氧化钠 | D. | 木炭与水蒸气 |
18.将0.2molMnO2和50mL12mol•L-1的盐酸混合后加热,待反应完全后,向反应后的溶液中加入足量AgNO3溶液,生成AgCl沉淀的物质的量为(盐酸的挥发忽略不计)( )
| A. | 等于0.3mol | B. | 大于0.3mol | ||
| C. | 大于0.3mol,小于0.6mol | D. | 等于0.6mol |