题目内容
3.下列电离方程式正确的是( )| A. | H2S?2H++S2- | B. | NaHSO4?Na ++HSO4- | ||
| C. | NaHCO3?Na++H++CO32- | D. | HCO3-?CO32-+H+ |
分析 A.硫化氢为二元弱酸,分步电离,以第一步为主;
B.碳酸氢钠为强电解质,完全电离,用等号,熔融状态电离产生钠离子和硫酸氢根离子;
C.碳酸氢钠为强电解质,电离生成钠离子和碳酸氢根离子;
D.碳酸氢根离子为弱酸的酸式根离子,部分电离生成氢离子和碳酸根离子.
解答 解:A.硫化氢为二元弱酸,分步电离,以第一步为主,电离方程式:H2S?H++HS-,故A错误;
B.碳酸氢钠为强电解质,完全电离,用等号,熔融状态电离产生钠离子和硫酸氢根离子,电离方程式:NaHSO4=Na ++HSO4-,故B错误;
C.碳酸氢钠为强电解质,电离生成钠离子和碳酸氢根离子,电离方程式:NaHCO3=Na++HCO3-,故C错误;
D.碳酸氢根离子为弱酸的酸式根离子,部分电离生成氢离子和碳酸根离子,电离方程式:HCO3-?CO32-+H+,故D正确;
故选:D.
点评 本题考查了电解质电离方程式的书写,明确电解质强弱及电离方式是解题关键,注意电离方程式遵循客观事实、遵循电荷守恒规律,遵循原子个数守恒规律.

练习册系列答案
相关题目
11.下列说法中,正确的是( )
| A. | 芳香烃就是指苯和苯的同系物 | |
| B. | 通常可从煤焦油中或通过石油的催化重整来获取芳香烃 | |
| C. | 乙苯分子中所有原子可以处于同一平面上 | |
| D. | 苯和甲苯既能发生取代反应又能发生加成反应 |
18.下列除去杂质的方法中,正确的是( )
| 选项 | 物质 | 杂质 | 除杂质的方法 |
| A | 稀盐酸 | 氯化钠 | 加入适量的氢氧化钠溶液 |
| B | 铜粉 | 铁粉 | 加入足量的稀盐酸溶解、过滤、洗涤 |
| C | 二氧化碳 | 一氧化碳 | 点燃 |
| D | 氯化钠溶液 | 氯化铜 | 加入过量铁粉、过滤 |
| A. | A | B. | B | C. | C | D. | D |
14.下列有关化学用语使用正确的是( )
| A. | 硫原子的原子结构示意图: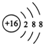 | B. | 纯碱的化学式:NaOH | ||
| C. | 原子核内有8个中子的氧原子:188O | D. | 氯化镁的电子式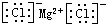 |
9.下列离子方程式书写正确的是( )
| A. | 醋酸钡与硫酸反应:Ba2++SO42-→BaSO4↓ | |
| B. | 金属铝溶于稀硫酸:Al+2H+→Al3++H2↓ | |
| C. | 将氯气溶于水制备次氯酸:Cl2+H2O→2H++Cl-+ClO- | |
| D. | 碳酸氢钠和盐酸反应:HCO3-+H+→CO2↑+H2O |
10.松萝酸常作为牙膏和化妆品的添加剂,可由三羟基苯乙酮两步反应得到,有关说法正确的是( )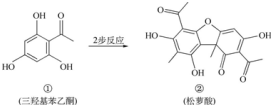

| A. | 有机物①的分子式为C8H6O4 | |
| B. | 有机物①在一定条件下能发生取代、加成和氧化反应 | |
| C. | 可用FeCl3溶液检验②中是否含有杂质① | |
| D. | 相同物质的量①、②与足量NaOH溶液反应,消耗NaOH的物质的量相同 |
 之比为2:3
之比为2:3