题目内容
18.将0.2molMnO2和50mL12mol•L-1的盐酸混合后加热,待反应完全后,向反应后的溶液中加入足量AgNO3溶液,生成AgCl沉淀的物质的量为(盐酸的挥发忽略不计)( )| A. | 等于0.3mol | B. | 大于0.3mol | ||
| C. | 大于0.3mol,小于0.6mol | D. | 等于0.6mol |
分析 发生反应为MnO2 +4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,当浓盐酸变成稀盐酸时,稀盐酸与二氧化锰不反应,根据氯元素守恒计算反应后溶液中n(Cl-),而n(AgCl)=n(Cl-),据此进行解答.
解答 解:50mL12mol•L-1的盐酸中含有HCl的物质的量为:n(HCl)=cV=50mL×12mol•L-1=0.6mol,
MnO2 +4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
1mol 4mol 1mol
0.2mol 0.6mol n(Cl2)
二氧化锰过量,n(Cl2)=0.15mol,但当浓盐酸变成稀盐酸时,稀盐酸与二氧化锰不反应,所以n(Cl2)<0.15mol
所以反应后溶液中n(Cl-)>0.6mol-0.15mol×2=0.3mol,
根据反应Cl-+Ag+=AgCl↓可知:n(AgCl)=n(Cl-)>0.3mol,
n(HCl)=cV=50mL×12mol•L-1=0.6mol 所以生成AgCl沉淀的物质的量0.3mol<n(AgCl)<0.6mol,
故选C.
点评 本题考查化学反应方程式的计算,为高频考点,把握发生的反应及稀盐酸与二氧化锰不反应为解答的关键,侧重分析能力与计算能力的综合考查,题目难度中等.

练习册系列答案
相关题目
11.下列说法中,正确的是( )
| A. | 芳香烃就是指苯和苯的同系物 | |
| B. | 通常可从煤焦油中或通过石油的催化重整来获取芳香烃 | |
| C. | 乙苯分子中所有原子可以处于同一平面上 | |
| D. | 苯和甲苯既能发生取代反应又能发生加成反应 |
9.下列离子方程式书写正确的是( )
| A. | 醋酸钡与硫酸反应:Ba2++SO42-→BaSO4↓ | |
| B. | 金属铝溶于稀硫酸:Al+2H+→Al3++H2↓ | |
| C. | 将氯气溶于水制备次氯酸:Cl2+H2O→2H++Cl-+ClO- | |
| D. | 碳酸氢钠和盐酸反应:HCO3-+H+→CO2↑+H2O |
6.下列应用或事实与胶体的性质无关的是( )
| A. | 洪灾发生地的农民用明矾净化河水作为生活用水 | |
| B. | 豆腐圣地安徽八公山豆制品厂用石膏或盐卤点制豆腐 | |
| C. | 在饱和氯化铁溶液中逐滴加入烧碱溶液,产生红褐色沉淀 | |
| D. | 安徽海螺集团各水泥厂用先进的电除尘技术除去空气中的粉尘 |
13.胶体区别于其它分散系的本质特征是( )
| A. | 胶体粒子直径在1-100nm之间 | B. | 胶体粒子带电荷 | ||
| C. | 胶体粒子能穿过滤纸 | D. | 胶体有丁达尔效应 |
3.下列说法正确的是( )
| A. | Na2O、Na2O2、CaO均属于碱性氧化物 | |
| B. | H2和HD属于同素异形体 | |
| C. | 蓝色的硫酸铜晶体遇到浓硫酸变白色属于化学变化 | |
| D. | 胶体带电,所以胶体具有电泳的性质 |
10.松萝酸常作为牙膏和化妆品的添加剂,可由三羟基苯乙酮两步反应得到,有关说法正确的是( )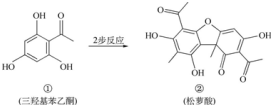

| A. | 有机物①的分子式为C8H6O4 | |
| B. | 有机物①在一定条件下能发生取代、加成和氧化反应 | |
| C. | 可用FeCl3溶液检验②中是否含有杂质① | |
| D. | 相同物质的量①、②与足量NaOH溶液反应,消耗NaOH的物质的量相同 |
7.分别将下列各组物质同时加到水中,得到无色透明溶液的是( )
| A. | FeCl3 NaOH KCl | B. | KCl Na2CO3 Na2SO4 | ||
| C. | BaCl2 NaCl Na2SO4 | D. | NaCl AgNO3 KCl |
8.分子式为C7H10O2的物质不可能为( )
| A. | 醇 | B. | 醛 | C. | 羧酸 | D. | 酚 |