题目内容
18.化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为H2(g)和Cl2(g)反应生成HCl (g)过程中的能量变化: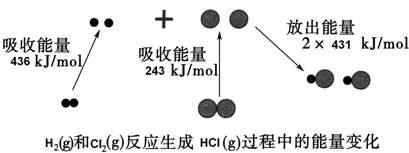
下列说法中正确的是( )
| A. | 1 mol H2(g)和1 mol Cl2(g)具有的总能量大于2 mol HCl(g)具有的总能量 | |
| B. | 该反应的△H>0 | |
| C. | 通常情况下,H2(g)和Cl2(g)混合容易直接生成HCl(g) | |
| D. | 生成的HCl溶于水会发生电离,即HCl=H++Cl-,由此判断,HCl中存在离子键 |
分析 A、分析能量变化大黑球代表氯原子,小黑球代表氢原子,依据反应焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量计算判断;
B.依据键能计算结果发现判断反应能量变化;
C.氢气和氯气需要一定条件下发生反应;
D.氯化氢是共价化合物,溶于水,在水分子作用下断裂共价键生成氢离子和氯离子;
解答 解:A.能量变化可知,反应焓变△H=断裂1 mol H2(g)和1 mol Cl2(g)化学键吸收的总能量-生成2molHCl化学键放出的能量=436KJ/mol+243KJ/mol-2×431KJ/mol=-183KJ/mol,反应为放热反应,1 mol H2(g)和1 mol Cl2(g)具有的总能量大于2 mol HCl(g)具有的总能量,故A正确;
B.依据A计算得到△H<0,反应为放热反应,故B错误;
C.氢气和氯气需要点燃或光照反应生成氯化氢,通常情况下,H2(g)和Cl2(g)混合不发生反应,故C错误;
D.氯化氢溶于水电离出离子是破坏了共价键,HCl不存在离子键,故D错误;
故选A.
点评 本题考查了化学反应能量变化、化学焓变的计算应用,注意物质的量的本质分析判断,掌握基础是解题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.下列说法中,正确的是( )
| A. | 芳香烃就是指苯和苯的同系物 | |
| B. | 通常可从煤焦油中或通过石油的催化重整来获取芳香烃 | |
| C. | 乙苯分子中所有原子可以处于同一平面上 | |
| D. | 苯和甲苯既能发生取代反应又能发生加成反应 |
14.下列有关化学用语使用正确的是( )
| A. | 硫原子的原子结构示意图: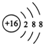 | B. | 纯碱的化学式:NaOH | ||
| C. | 原子核内有8个中子的氧原子:188O | D. | 氯化镁的电子式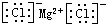 |
3.下列处理事故的方法正确的是( )
| A. | 电器着火,迅速用水灭 | |
| B. | 天然气泄漏,迅速开灯,查找泄漏点 | |
| C. | 图书着火,用干粉灭火器灭火 | |
| D. | 被围困在火灾区时,用湿毛巾捂住口鼻低下身子逃生 |
9.下列离子方程式书写正确的是( )
| A. | 醋酸钡与硫酸反应:Ba2++SO42-→BaSO4↓ | |
| B. | 金属铝溶于稀硫酸:Al+2H+→Al3++H2↓ | |
| C. | 将氯气溶于水制备次氯酸:Cl2+H2O→2H++Cl-+ClO- | |
| D. | 碳酸氢钠和盐酸反应:HCO3-+H+→CO2↑+H2O |
6.下列应用或事实与胶体的性质无关的是( )
| A. | 洪灾发生地的农民用明矾净化河水作为生活用水 | |
| B. | 豆腐圣地安徽八公山豆制品厂用石膏或盐卤点制豆腐 | |
| C. | 在饱和氯化铁溶液中逐滴加入烧碱溶液,产生红褐色沉淀 | |
| D. | 安徽海螺集团各水泥厂用先进的电除尘技术除去空气中的粉尘 |
7.分别将下列各组物质同时加到水中,得到无色透明溶液的是( )
| A. | FeCl3 NaOH KCl | B. | KCl Na2CO3 Na2SO4 | ||
| C. | BaCl2 NaCl Na2SO4 | D. | NaCl AgNO3 KCl |