题目内容
18.为了避免NO、NO2、N2O4对大气的污染,常采用氢氧化钠溶液进行吸收处理(反应方程式:2NO2+2NaOH═NaNO2+H2O+NaNO3,NO2+NO+2NaOH═2NaNO2+H2O).现有由a mol NO、b molNO2、c molN2O4组成的混合气体恰好被VL氢氧化钠溶液吸收(无气体剩余),则此氢氧化钠溶液的物质的量浓度为(mol/L)( )| A. | $\frac{a+b+c}{V}$mol•L-1 | B. | $\frac{a+b+2c}{V}$mol•L-1 | C. | $\frac{2a+b+c}{V}$mol•L-1 | D. | $\frac{b+2c}{V}$mol•L-1 |
分析 恰好反应时需要氢氧化钠最少,由钠离子守恒可知:n(NaOH)=n(NaNO3)+n(NaNO2),根据N原子守恒可知n(NaNO3)+n(NaNO2)=n(NO)+n(NO2)+2n(N2O4),再根据c=$\frac{n}{V}$计算氢氧化钠溶液最小浓度.
解答 解:恰好反应时需要氢氧化钠最少,由钠离子守恒可知:n(NaOH)=n(NaNO3)+n(NaNO2),根据N原子守恒可知n(NaNO3)+n(NaNO2)=n(NO)+n(NO2)+2n(N2O4),故n(NaOH)=n(NO)+n(NO2)+2n(N2O4)=amol+bmol+2cmol=(a+b+2c)mol,故氢氧化钠溶液最小浓度=$\frac{(a+b+2c)mol}{VL}$=$\frac{a+b+2c}{V}$mol/L,
故选B.
点评 本题考查化学方程式有关计算,属于字母型计算,侧重解题方法与思维能力的考查,注意利用守恒思想解答,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.同温同压下,收集两瓶相同体积的CH4和CO2气体,下列叙述中正确的是( )
| A. | 质量比1:1 | B. | 原子数比1:1 | C. | 分子数比1:1 | D. | 密度比1:1 |
6.下列关于反应能量的说法正确的是( )
| A. | Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)△H=-216 kJ•mol-1,E反应物<E生成物 | |
| B. | CaCO3(s)═CaO(s)+CO2(g)△H=+178.5 kJ•mol-1,E反应物<E生成物 | |
| C. | HI(g)═$\frac{1}{2}$H2(g)+$\frac{1}{2}$I2(s)△H=-26.5 kJ•mol-1,1 mol HI在密闭容器中分解后放出26.5 kJ的热量 | |
| D. | H+(aq)+OH-(aq)═H2O(l)△H=-57.2 kJ•mol-1,含1 mol NaOH水溶液与含0.5 mol的浓硫酸混合后放热57.2 kJ |
13.关于下列各装置图的叙述中,正确的是( )
| A. | 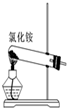 实验室用如图装置制取氨气 | |
| B. |  装置可用于制备氢氧化亚铁并观察其颜色 | |
| C. | 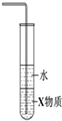 如图装置中X若为四氯化碳,可用于吸收氨气,并防止倒吸 | |
| D. | 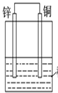 如图装置是原电池,锌电极为负极,发生还原反应 |
3.关于盐酸、硫酸、硝酸的说法正确的是( )
| A. | 都是含氧酸 | B. | 都是一元酸 | ||
| C. | 都易挥发 | D. | 都能发生中和反应 |
10.我国已成功研发出133Cs原子喷泉钟,使我国时间频率基准的精度从30万年不差1秒提高到600万年不差1秒,标志着我国时间频率基准研究进入世界先进行列.下列关于铯的说法中不正确的是( )
| A. | 氢氧化铯的碱性非常强 | |
| B. | 碱金属单质中铯的沸点最低 | |
| C. | 将一小块铯投入水中,实验现象与钠和水反应的完全相同 | |
| D. | 铯可以与很多非金属反应,形成离子化合物 |
7.下列能用勒夏特列原理解释的是( )
| A. | 溴水中存在下列平衡Br2+H2O?HBr+HBrO,加入AgNO3溶液后,溶液颜色变浅 | |
| B. | 工业上由氢气和氮气合成氨是在较高温度下进行的 | |
| C. | SO2催化氧化成SO3的反应,需要使用催化剂 | |
| D. | H2、I2、HI平衡混和气加压后颜色变深 |
 某温度下,在恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度均为0.20mol/L,发生反应:H2(g)+CO2(g)?H2O(g)+CO(g).CO(g)的浓度随时间变化如图所示.
某温度下,在恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度均为0.20mol/L,发生反应:H2(g)+CO2(g)?H2O(g)+CO(g).CO(g)的浓度随时间变化如图所示.
 或
或 (写1种);由Ⅳ生成Ⅱ的反应条件为NaOH的醇溶液、加热.
(写1种);由Ⅳ生成Ⅱ的反应条件为NaOH的醇溶液、加热.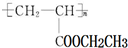 可用于制备涂料,其单体结构简式为CH2=CHCOOCH2CH3.
可用于制备涂料,其单体结构简式为CH2=CHCOOCH2CH3.