题目内容
8.不饱和酯类化合物在药物、涂料等应用广泛.
(1)Ⅰ中含有的含氧官能团的名称为羟基、酯基下列关于化合物I的说法,正确的是AC.
A.遇FeCl3溶液可能显紫色
B.可发生酯化反应和银镜反应
C.能与溴发生取代和加成反应
D.1mol化合物I最多能与2molNaOH反应
(2)①化合物Ⅱ的分子式为C9H10,1mol化合物Ⅱ能与4molH2恰好完全反应生成饱和烃类化合物.
②化合物Ⅱ可由芳香族化合物Ⅲ或IV分别通过消去反应获得,但只有Ⅲ能与Na反应产生H2,
Ⅲ的结构简式为
 或
或 (写1种);由Ⅳ生成Ⅱ的反应条件为NaOH的醇溶液、加热.
(写1种);由Ⅳ生成Ⅱ的反应条件为NaOH的醇溶液、加热.③聚合物
 可用于制备涂料,其单体结构简式为CH2=CHCOOCH2CH3.
可用于制备涂料,其单体结构简式为CH2=CHCOOCH2CH3.
分析 (1)有机物含有碳碳双键,可发生加成、加聚和氧化反应,含有酚羟基,可发生取代、氧化和显色反应,含有酯基,可发生水解反应;
(2)①Ⅱ中含有9个C原子、10个H原子,据此确定化学式;能和氢气发生加成反应的有苯环和碳碳双键;
②化合物Ⅱ可由芳香族化合物Ⅲ或Ⅳ分别通过消去反应获得,但只有Ⅲ能与Na反应产生H2,说明Ⅲ中含有醇羟基,醇羟基可位于碳碳双键两端的任一个C原子上;Ⅳ是卤代烃,卤代烃和氢氧化钠的醇溶液发生消去反应;
③聚合物 可用于制备涂料,其单体为丙烯酸乙酯.
可用于制备涂料,其单体为丙烯酸乙酯.
解答 解:(1)由I的结构可知,含有的含氧官能团有羟基、酯基;
A.分子中含有酚羟基,则遇FeCl3溶液可能显紫色,故A正确;
B.分子中不含有醛基,则不能发生银镜反应,故B错误;
C.分子中含有C=C,能与溴单质发生加成反应,含有酚羟基能与溴单质发生取代反应,故C正确;
D.分子中含有2个酚羟基和1个酯基,都可与氢氧化钠反应,则1mol化合物最多能与3molNaOH反应,故D错误,
故答案为:羟基、酯基;AC;
(2)①Ⅱ中含有9个C原子、10个H原子,其化学式为C9H10;能和氢气发生加成反应的有苯环和碳碳双键,1mol化合物Ⅱ能与4mol H2恰好完全反应生成饱和烃类化合物,
故答案为:C9H10;4;
②化合物Ⅱ可由芳香族化合物Ⅲ或Ⅳ分别通过消去反应获得,但只有Ⅲ能与Na反应产生H2,说明Ⅲ中含有醇羟基,醇羟基可位于碳碳双键两端的任一个C原子上,其结构简式为 或
或 ;Ⅳ是卤代烃,卤代烃和氢氧化钠的醇溶液发生消去反应,所以其反应条件是氢氧化钠的醇溶液、加热;
;Ⅳ是卤代烃,卤代烃和氢氧化钠的醇溶液发生消去反应,所以其反应条件是氢氧化钠的醇溶液、加热;
故答案为: 或
或 ;NaOH醇溶液、加热;
;NaOH醇溶液、加热;
③聚合物 可用于制备涂料,其单体为丙烯酸乙酯,结构简式为CH2=CHCOOCH2CH3,
可用于制备涂料,其单体为丙烯酸乙酯,结构简式为CH2=CHCOOCH2CH3,
故答案为:CH2=CHCOOCH2CH3.
点评 本题考查有机物的结构与性质,关键是对官能团及其性质掌握,题目难度中等.

| A. | $\frac{a+b+c}{V}$mol•L-1 | B. | $\frac{a+b+2c}{V}$mol•L-1 | C. | $\frac{2a+b+c}{V}$mol•L-1 | D. | $\frac{b+2c}{V}$mol•L-1 |

已知:K2FeO4在水溶液中易发生反应:4FeO42-+10H2O?4Fe(OH)3+8OH-+3O2↑,下列说法不正确的是( )
| A. | 步骤③中氧化剂与还原剂的物质的量之比为3:2 | |
| B. | 步骤④中Na2FeO4转变为湿产品是因为K2FeO4溶解度更小 | |
| C. | 步骤⑤中的洗涤剂可用CH3COOK和异丙醇来配制 | |
| D. | 配制90%Fe(NO3)3溶液必需的玻璃仪器有容量瓶、烧杯、量筒、玻璃棒 |
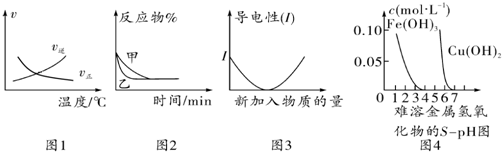
| A. | 根据图1可判断可逆反应“A2(g)+3B2(g)?2AB3(g)”的△H<0 | |
| B. | 图2可能表示压强对可逆反应 A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强大 | |
| C. | 图3可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 | |
| D. | 根据图4,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量Cu至pH在4左右 |
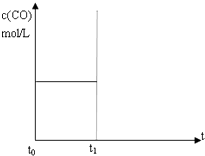 水煤气(CO 和H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:C (s)+H2O(g)?CO(g)+H2 (g)△H=+131.3kJ•mol-1
水煤气(CO 和H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:C (s)+H2O(g)?CO(g)+H2 (g)△H=+131.3kJ•mol-1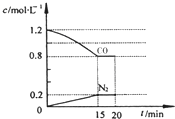 回答下列问题:
回答下列问题: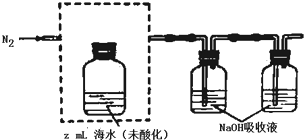
 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.