题目内容
7.下列能用勒夏特列原理解释的是( )| A. | 溴水中存在下列平衡Br2+H2O?HBr+HBrO,加入AgNO3溶液后,溶液颜色变浅 | |
| B. | 工业上由氢气和氮气合成氨是在较高温度下进行的 | |
| C. | SO2催化氧化成SO3的反应,需要使用催化剂 | |
| D. | H2、I2、HI平衡混和气加压后颜色变深 |
分析 勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动,使用勒夏特列原理时,该反应必须是可逆反应且存在平衡过程,否则勒夏特列原理不适用.
解答 解:A.溴水中存在下列平衡Br2+H2O?HBr+HBrO,加入AgNO3溶液后,AgNO3和HBr反应生成AgBr沉淀而促进平衡正向移动,则溶液颜色变浅,所以可以用平衡移动原理解释,故A选;
B.合成氨的正反应是放热反应,升高温度平衡逆向元素,不利于合成氨生产,但在较高温度下反应速率较大,则合成氨在较高温度下进行不能用平衡移动原理解释,故B不选;
C.催化剂只改变反应速率不影响平衡移动,所以不能用平衡移动原理解释,故C不选;
D.增大压强平衡不移动,但浓度增大,则颜色加深,不能用勒沙特列原理解释,故D不选;
故选A.
点评 本题考查化学平衡移动原理,为高频考点,注意:只有“改变条件能引起平衡移动的可逆反应”才能用平衡移动原理解释,易错选项是D.

练习册系列答案
相关题目
18.为了避免NO、NO2、N2O4对大气的污染,常采用氢氧化钠溶液进行吸收处理(反应方程式:2NO2+2NaOH═NaNO2+H2O+NaNO3,NO2+NO+2NaOH═2NaNO2+H2O).现有由a mol NO、b molNO2、c molN2O4组成的混合气体恰好被VL氢氧化钠溶液吸收(无气体剩余),则此氢氧化钠溶液的物质的量浓度为(mol/L)( )
| A. | $\frac{a+b+c}{V}$mol•L-1 | B. | $\frac{a+b+2c}{V}$mol•L-1 | C. | $\frac{2a+b+c}{V}$mol•L-1 | D. | $\frac{b+2c}{V}$mol•L-1 |
15.下列实验方法能达到实验目的是( )
| A. | 用分液漏斗分离水与乙醇的混合物 | |
| B. | 用激光笔检验淀粉溶液的丁达尔现象 | |
| C. | 用氯化钡溶液鉴别碳酸钠溶液与硫酸钠溶液 | |
| D. | 向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体 |
2.以下数值等于阿伏加德罗常数值的是( )
| A. | 6 g石墨中的C-C键数目 | |
| B. | 常温常压下,17 g ND3中所含分子数目 | |
| C. | 向含0.2 mol NH4Al(SO4)2的溶液中滴加NaOH溶液至沉淀完全溶解,消耗的OH-数目 | |
| D. | 0.1 mol羟基(-OH)中所含电子数目 |
12.氰(CN)2,硫氰(SCN)2等称为拟卤素,与卤素单质性质相似,它们的阴离子与也卤素阴离子性质相似,阴离子的还原性顺序为:Cl-<Br-<CN-<SCN-<I-,又知,拟卤素形成的无氧酸和含氧酸一般为弱酸,下列反应中,不合理的是( )
| A. | 4HCN(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Mn(CN)2+(CN)2↑+2H2O | |
| B. | (CN)2+H2O═2H++CN-+CNO- | |
| C. | (CN)2+2OH-═CN-+CNO-+H2O | |
| D. | (CN)2+2SCN-═2CN-+(SCN)2 |
16.高铁酸钾(K2FeO4)具有强氧化性,是一种新型多功能水处理剂,其生产工艺流程如下:
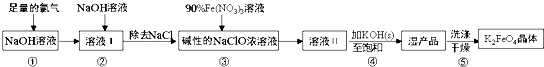
已知:K2FeO4在水溶液中易发生反应:4FeO42-+10H2O?4Fe(OH)3+8OH-+3O2↑,下列说法不正确的是( )

已知:K2FeO4在水溶液中易发生反应:4FeO42-+10H2O?4Fe(OH)3+8OH-+3O2↑,下列说法不正确的是( )
| A. | 步骤③中氧化剂与还原剂的物质的量之比为3:2 | |
| B. | 步骤④中Na2FeO4转变为湿产品是因为K2FeO4溶解度更小 | |
| C. | 步骤⑤中的洗涤剂可用CH3COOK和异丙醇来配制 | |
| D. | 配制90%Fe(NO3)3溶液必需的玻璃仪器有容量瓶、烧杯、量筒、玻璃棒 |
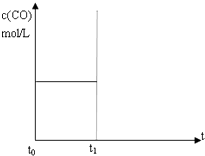 水煤气(CO 和H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:C (s)+H2O(g)?CO(g)+H2 (g)△H=+131.3kJ•mol-1
水煤气(CO 和H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:C (s)+H2O(g)?CO(g)+H2 (g)△H=+131.3kJ•mol-1 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.