题目内容
一定条件下,向2L密闭容器中加入2mol N2和10mol H2发生反应N2+3H2?2NH3,2min时测得剩余N2为1mol,此时表示的化学反应速率正确的是( )
| A、v(N2)=0.25 mol?(L?min)-1 |
| B、v(H2)=0.75 mol?(L?min)-1 |
| C、v(NH3)=1 mol?(L?min)-1 |
| D、v(NH3)=0.25mol?(L?min)-1 |
考点:反应速率的定量表示方法
专题:化学反应速率专题
分析:根据v=
计算v(N2),再利用速率之比等于化学计量数之比计算v(H2)、v(NH3),据此判断.
| △c |
| △t |
解答:
解:在一定条件下,向1L密闭容器中加入2mol N2和10molH2,发生反应N2+3H2?2NH3,2分钟末时,测得剩余氮气为1mol,
故2min内,以 N2表示的反应速率v(N2)=
=0.25 mol/(L?min),根据速率之比等于化学计量数之比可知:
v(H2)=3v(N2)=3×0.25 mol/(L?min)=0.75 mol/(L?min),
v(NH3)=2v(N2)=2×0.25 mol/(L?min)=0.5mol/(L?min),
故选AB.
故2min内,以 N2表示的反应速率v(N2)=
| ||
| 2min |
v(H2)=3v(N2)=3×0.25 mol/(L?min)=0.75 mol/(L?min),
v(NH3)=2v(N2)=2×0.25 mol/(L?min)=0.5mol/(L?min),
故选AB.
点评:本题考查化学反应速率的计算,比较基础,常用计算方法有定义法与化学计量数法,根据情况选择合适的计算方法.

练习册系列答案
相关题目
共价键、离子键和范德华力都是微粒之间的作用力,下列含有上述两种结合力的是( )
①Na2O2 ②SiO2 ③干冰 ④金刚石 ⑤NaCl ⑥白磷.
①Na2O2 ②SiO2 ③干冰 ④金刚石 ⑤NaCl ⑥白磷.
| A、①②④ | B、①③⑥ |
| C、②④⑥ | D、③④⑤ |
M、N为短周期的两种元素,M元素原子的最外层电子数≤4,N元素原子的最外层电子数>4,下列对其中说法正确的是( )
| A、M、N可能为金属 |
| B、若M、N为同周期元素,则原子半径M<N |
| C、M、N元素的单质可能与水发生置换反应 |
| D、M、N形成的离子化合物不能体现强氧化性 |
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A、1 mol钠与氧气反应生成Na2O或Na2O2时,失电子数目均为NA |
| B、标准状况下,2.24 L Cl2与过量NaOH溶液反应,转移的电子总数为0.2NA |
| C、1 mol/L的NaOH溶液中含Na+数目为NA |
| D、标准状况下,11.2 L CCl4中的C-Cl键数目为2NA |
下列实验方案合理的是( )
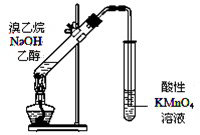

| A、鉴别苯和甲苯:分别加入溴水振荡 |
| B、检验酒精中的少量水:向酒精中加入无水硫酸铜 |
| C、制备纯净的氯乙烷(C2H5Cl):将乙烷和氯气的混合气放在光照条件下反应 |
| D、证明溴乙烷与NaOH醇溶液共热生成乙烯:用如图所示的实验装置 |
某气态烃10mL与50mL氧气在一定条件下作用,刚好耗尽反应物,生成水蒸气40mL、一氧化碳和二氧化碳各20mL(各体积都是在同温同压下测得).该气态烃为( )
| A、C3H8 |
| B、C4H6 |
| C、C3H6 |
| D、C4H8 |
在298K下,铅室法生产硫酸存在如下三个平衡:下列有关说法正确的是( )
①SO2(g)+NO2(g)?SO3(g)+NO(g)△H1=-10.0kJ?mol-1
②2NO(g)+O2(g)?2NO2(g)△H2=-27.3kJ?mol-1
③2SO2(g)+O2(g)?2SO3(g)△H3.
①SO2(g)+NO2(g)?SO3(g)+NO(g)△H1=-10.0kJ?mol-1
②2NO(g)+O2(g)?2NO2(g)△H2=-27.3kJ?mol-1
③2SO2(g)+O2(g)?2SO3(g)△H3.
| A、298K,反应③的△H3═+47.3 kJ?mol-1 |
| B、平衡时,其他条件不变,升高温度,反应①中正反应速率加快 |
| C、平衡时,其他条件不变,增大NO2浓度可增大反应③中SO2转化率 |
| D、反应③中,每有1mol O=O键断裂,同时生成2molSO3,则该反应达平衡状态 |
氢化钠(NaH)化合物中钠元素是+1价,NaH跟水反应放出H2,下列叙述正确的是( )
| A、在NaH中的氢离子半径比锂离子半径大 |
| B、在NaH中的氢离子的电子层排布与氦原子不相同 |
| C、NaH跟水反应后溶液呈酸性 |
| D、NaH中的氢离子被还原成氢气 |