题目内容
8.下列化学用语中,正确的是( )| A. | 氯化钠的电子式为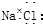 ? ? | |
| B. | 乙烯的结构简式:CH2CH2 | |
| C. | 氯化氢分子的形成过程可用电子式表示为:H×+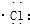 → → | |
| D. | 重水的化学式为${\;}_{1}^{2}$H2O(或D2O) |
分析 A.氯化钠为离子化合物,阴阳离子需要标出所带电荷;
B.乙烯的结构简式中漏掉了碳碳双键;
C.氯化氢为共价化合物,分子中不存在阴阳离子;
D.重水分子中H原子的质量数为2,可以用${\;}_{1}^{2}$H2O或D2O表示.
解答 解:A.氯化钠中存在钠离子和铝离子,钠离子直接用离子符号表示,阴离子需要标出最外层电子,氯化钠正确的电子式为: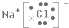 ,故A错误;
,故A错误;
B.乙烯分子中含有碳碳双键,乙烯正确的结构简式为:CH2=CH2,故B错误;
C.氯化氢属于共价化合物,分子中不存在阴阳离子,用电子式表示氯化氢的形成过程为: ,故C错误;
,故C错误;
D.重水分子中含有重氢原子,重水的化学式为:${\;}_{1}^{2}$H2O(或D2O),故D正确;
故选D.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、化学式、结构简式等知识,明确常见化学用语的书写原则为解答关键.

练习册系列答案
 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
1.如图1是某化学兴趣小组设计的利用电子垃圾(含70%Cu、25%Al、4%Fe及少量Au、Pt)制备硫酸铜和硫酸铝晶体的路线:
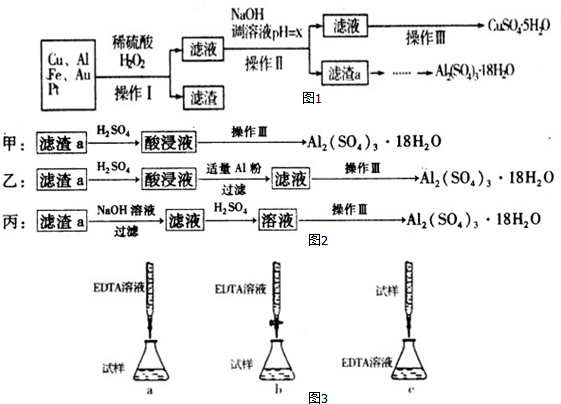
已知下列信息:
Cu可与稀硫酸和H2O2的混合液反应生成硫酸铜;铁、铝、铜等离子以氢氧化物形式沉淀时溶液的pH如表:
请回答下列问题:
(1)操作Ⅰ后,滤渣中有Au、Pt_金属.
(2)写出Cu与稀硫酸和H2O2的混合液反应的离子方程式:Cu+H2O2+2H+=Cu2++2H2O.
(3)在操作Ⅱ中,x的取值范围是5.2≤x<5.4.
(4)由滤渣a制取Al2(SO4)3•l8H2O,探究小组设计了如图2三种方案:综合考虑上述三种方案,最具可行性的是乙(填序号).
(5)为测定CuSO4•5H2O晶体的纯度,进行下列实验:取a g试样配成l00mL溶液,每次取20.00mL,消除干扰离子后,用b mol•L-1EDTA(Na2H2Y)标准溶液滴定其中的Cu2+(离子方程式为Cu2++H2Y2-=CuY2-+2H+),滴定至终点,平均消耗EDTA溶液l2.00mL.(常温时,5%的Na2H2Y水溶液,其pH为4-6.)
①CuSO4•5H2O晶体的纯度是$\frac{15b}{a}$×100%.
②如图3滴定方式中,最合理的是(夹持部分略去)b(填序号).

已知下列信息:
Cu可与稀硫酸和H2O2的混合液反应生成硫酸铜;铁、铝、铜等离子以氢氧化物形式沉淀时溶液的pH如表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 |
| 开始沉淀 | 1.1 | 4.0 | 5.4 |
| 完全沉淀 | 3.2 | 5.2 | 6.7 |
(1)操作Ⅰ后,滤渣中有Au、Pt_金属.
(2)写出Cu与稀硫酸和H2O2的混合液反应的离子方程式:Cu+H2O2+2H+=Cu2++2H2O.
(3)在操作Ⅱ中,x的取值范围是5.2≤x<5.4.
(4)由滤渣a制取Al2(SO4)3•l8H2O,探究小组设计了如图2三种方案:综合考虑上述三种方案,最具可行性的是乙(填序号).
(5)为测定CuSO4•5H2O晶体的纯度,进行下列实验:取a g试样配成l00mL溶液,每次取20.00mL,消除干扰离子后,用b mol•L-1EDTA(Na2H2Y)标准溶液滴定其中的Cu2+(离子方程式为Cu2++H2Y2-=CuY2-+2H+),滴定至终点,平均消耗EDTA溶液l2.00mL.(常温时,5%的Na2H2Y水溶液,其pH为4-6.)
①CuSO4•5H2O晶体的纯度是$\frac{15b}{a}$×100%.
②如图3滴定方式中,最合理的是(夹持部分略去)b(填序号).
19.将下列气体通入水中,既能生成含氧酸,又能生成无氧酸的( )
| A. | 氯气 | B. | 二气体氧化氮 | C. | 硫化氢 | D. | 二氧化碳 |
16.生活中处处有化学,下列相关表述正确的是( )
| A. | 苯酚沾在皮肤上可用氢氧化钠溶液清洗 | |
| B. | 甘油可用于配制化妆品 | |
| C. | 使用无氟制冷剂有利于降低大气中的二氧化碳 | |
| D. | “低碳”是指采用含碳量低的烃类作为燃料 |
3.咖啡酸的结构简式为: ,关于它的说法正确的是( )
,关于它的说法正确的是( )
 ,关于它的说法正确的是( )
,关于它的说法正确的是( )| A. | 1mol咖啡酸能和1mol NaOH溶液反应 | |
| B. | 1 mol咖啡酸与足量Na反应放出1.5molH2 | |
| C. | 1mol咖啡酸能和3molBr2发生反应 | |
| D. | 咖啡酸不能和FeCl3溶液发生显色反应 |
 石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图所示,M原子位于晶胞的棱上与内部,C60位于晶胞的顶点与面心,则该晶胞中C60的个数为4,该材料的化学式为M3C60.
石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图所示,M原子位于晶胞的棱上与内部,C60位于晶胞的顶点与面心,则该晶胞中C60的个数为4,该材料的化学式为M3C60.