题目内容
1.如图1是某化学兴趣小组设计的利用电子垃圾(含70%Cu、25%Al、4%Fe及少量Au、Pt)制备硫酸铜和硫酸铝晶体的路线: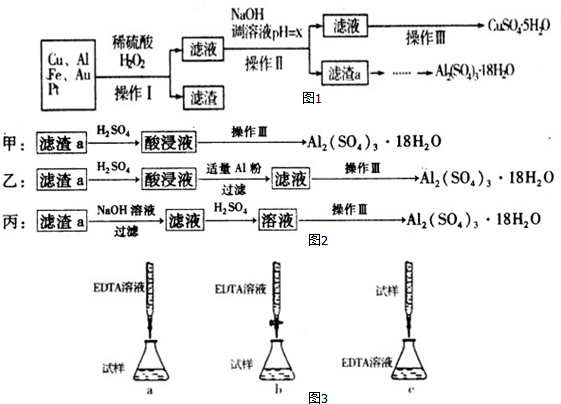
已知下列信息:
Cu可与稀硫酸和H2O2的混合液反应生成硫酸铜;铁、铝、铜等离子以氢氧化物形式沉淀时溶液的pH如表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 |
| 开始沉淀 | 1.1 | 4.0 | 5.4 |
| 完全沉淀 | 3.2 | 5.2 | 6.7 |
(1)操作Ⅰ后,滤渣中有Au、Pt_金属.
(2)写出Cu与稀硫酸和H2O2的混合液反应的离子方程式:Cu+H2O2+2H+=Cu2++2H2O.
(3)在操作Ⅱ中,x的取值范围是5.2≤x<5.4.
(4)由滤渣a制取Al2(SO4)3•l8H2O,探究小组设计了如图2三种方案:综合考虑上述三种方案,最具可行性的是乙(填序号).
(5)为测定CuSO4•5H2O晶体的纯度,进行下列实验:取a g试样配成l00mL溶液,每次取20.00mL,消除干扰离子后,用b mol•L-1EDTA(Na2H2Y)标准溶液滴定其中的Cu2+(离子方程式为Cu2++H2Y2-=CuY2-+2H+),滴定至终点,平均消耗EDTA溶液l2.00mL.(常温时,5%的Na2H2Y水溶液,其pH为4-6.)
①CuSO4•5H2O晶体的纯度是$\frac{15b}{a}$×100%.
②如图3滴定方式中,最合理的是(夹持部分略去)b(填序号).
分析 由流程可知,金属混合物加入稀硫酸后铝、铁溶解,加入过氧化氢,亚铁离子被氧化为铁离子,铜在酸性溶液中被过氧化氢氧化为铜离子,过滤得到滤渣为Au、Pt,滤液中主要含有铁离子、铝离子和铜离子,加入氢氧化钠溶液调节溶液PH=5.2-5.4使铝离子全部沉淀,同时铁离子也转化为沉淀,过滤得到滤渣a为Al(OH)3和Fe(OH)3,用硫酸溶解后加Al调节pH,把铁离子转化为沉淀,过滤,滤液为硫酸铝溶液,蒸发、浓缩、冷却、结晶、过滤得到Al2(SO4)2•18H2O晶体;含有硫酸铜的滤液,通过蒸发浓缩,冷却结晶,过滤洗涤得到硫酸铜晶体;
(1)操作Ⅰ后,过滤得到滤渣为Au、Pt;
(2)酸性条件下铜被双氧水氧化成铜离子;
(3)调节pH使铁离子和铝离子完全沉淀,铜离子不沉淀,根据表中数据判断;
(4)滤渣a是氢氧化铝和氢氧化铁,用硫酸溶解,调节pH除去铁离子;
(5)①根据反应方程式及滴定数据计算出硫酸铜的物质的量,再计算出硫酸铜晶体的质量分数;
②EDTA(Na2H2Y)标准溶液滴定其中的Cu2+,则EDTA盛放在酸式滴定管中.
解答 解:(1)操作Ⅰ后,过滤得到滤渣为Au、Pt,
故答案为:Au、Pt;
(2)酸性条件下铜被双氧水氧化成铜离子,则Cu与双氧水、硫酸反应生成硫酸铜和水,则反应的离子方程式为:Cu+H2O2+2H+=Cu2++2H2O,
故答案为:Cu+H2O2+2H+=Cu2++2H2O;
(3)调节pH使铁离子和铝离子完全沉淀,铜离子不沉淀,根据表中数据可知pH=5.2是铝离子完全沉淀,pH=5.4时铜离子开始沉淀,所以调节pH为5.2≤x<5.4,
故答案为:5.2≤x<5.4;
(4)滤渣a是氢氧化铝和氢氧化铁,用硫酸溶解,得到硫酸铝和硫酸铁,加入Al调节pH使铁离子转化为氢氧化铁沉淀,过滤除去沉淀,则剩余的滤液为硫酸铝沉淀,然后蒸发浓缩得到硫酸铝晶体;所以乙方案符合;
故答案为:乙;
(5)①根据方程式可知20.00mL溶液中n(CuSO4•5H2O)=n(EDTA)=b×12×10-3mol;
所以m(CuSO4•5H2O)=b×12×10-3mol×250g/mol=3bg,
因此100mL溶液中CuSO4•5H2O的质量为:3b×5=15bg,所以ω=$\frac{15b}{a}$×100%,
故答案为:$\frac{15b}{a}$×100%;
②EDTA(Na2H2Y)标准溶液滴定其中的Cu2+,则EDTA盛放在滴定管中,该溶液显酸性,用酸式滴定管,所以最合理的为b;
故答案为:b.
点评 本题考查了物质的制备实验方案设计,题目涉及方程式的书写、除杂质、实验基本操作、物质含量的测定等,题目考查的知识点较多,侧重于基础知识的综合应用的考查,题目难度中等.

 小学期末标准试卷系列答案
小学期末标准试卷系列答案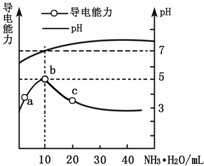 常温下,向10mL 0.1mol•L-1的HR溶液中逐滴滴入0.1mol•L-1的氨水,所得溶液pH及导电性变化如图.下列分析不正确的是( )
常温下,向10mL 0.1mol•L-1的HR溶液中逐滴滴入0.1mol•L-1的氨水,所得溶液pH及导电性变化如图.下列分析不正确的是( )| A. | b点溶液pH=5,此时酸碱恰好中和 | |
| B. | a~b点导电能力增强,说明HR为弱酸 | |
| C. | c点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+) | |
| D. | b~c任意点溶液均有c(H+)•c(OH-)=KW=1.0×10-14 |
| A. | 与铜质水龙头连接处的钢质水管不易发生腐蚀 | |
| B. | 一种金属元素可能有多种氧化物,同一金属同一价态也可能有多种氧化物 | |
| C. | 金属钠、镁等金属着火时,可以使用泡沫灭火器来灭火 | |
| D. | 工业上可用铝热反应大规模炼铁 |
| A. | 由乙酸和乙醇制乙酸乙酯 | B. | 由乙醇制乙烯 | ||
| C. | 由丙烯与溴制1,2-二溴丙烷 | D. | 由甲苯氧化制苯甲酸 |
| A. | 氯化钠的电子式为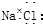 ? ? | |
| B. | 乙烯的结构简式:CH2CH2 | |
| C. | 氯化氢分子的形成过程可用电子式表示为:H×+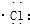 → →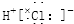 | |
| D. | 重水的化学式为${\;}_{1}^{2}$H2O(或D2O) |
 SO3(g)的平衡常数K1=20,在同一温度下,反应2SO3(g)
SO3(g)的平衡常数K1=20,在同一温度下,反应2SO3(g) 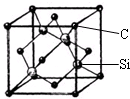 铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:
铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:

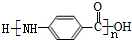 .
.