题目内容
4.200ml Fe2(SO4)3溶液中SO42-的物质的量浓度是7.5mol/L,则该溶液中含Fe3+56g.向该溶液中加入1.5mol的BaCl2溶液可使SO42-恰好沉淀,反应的离子方程式为Ba2++SO42-=BaSO4↓.分析 根据化学式知,硫酸铁溶液中c(SO42-):c(Fe3+)=3:2,则该溶液中c(Fe3+)=$\frac{2}{3}$c(SO42-)=$\frac{2}{3}$×7.5mol/L=5mol/L,根据m=nM计算铁离子质量;
硫酸铁和氯化钡发生复分解反应生成硫酸钡沉淀,离子方程式为Ba2++SO42-=BaSO4↓,根据离子方程式知,参加反应的n(Ba2+)=n(SO42-),根据Ba原子守恒计算n(BaCl2).
解答 解:根据化学式知,硫酸铁溶液中c(SO42-):c(Fe3+)=3:2,则该溶液中c(Fe3+)=$\frac{2}{3}$c(SO42-)=$\frac{2}{3}$×7.5mol/L=5mol/L,m(Fe3+)=nM=cVM=5mol/L×0.2L×56g/mol=56g;
硫酸铁和氯化钡发生复分解反应生成硫酸钡沉淀,离子方程式为Ba2++SO42-=BaSO4↓,根据离子方程式知,参加反应的n(Ba2+)=n(SO42-)=cV=7.5mol/L×0.2L=1.5mol,根据Ba原子守恒得n(BaCl2)=n(Ba2+)=1.5mol,
故答案为:56;1.5;Ba2++SO42-=BaSO4↓.
点评 本题考查物质的量的有关计算,为高频考点,明确各个微粒之间关系是解本题关键,注意原子守恒的灵活运用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.碘元素有“智力元素”之称.研究性学习小组做了如下实验探究海带中碘元素存在并测定其中碘元素的含量.
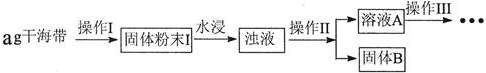
(1)操作Ⅰ为灼烧,则灼烧时用坩埚 盛装海带,操作Ⅱ为过滤
(2)水浸时通常要将悬浊液煮沸2-3min,目的是加快含碘物质在水中的溶解,以使灰烬中的含碘物质尽可能多的进入溶液
(3)操作Ⅲ,是同学们对溶液A中碘元素的存在形式进行的探究实验.
[推测]:①以IO3-形式存在; ②以I-形式存在
[查阅资料]:IO3-具有较强的氧化性,I2+2S2O32-═2I-+S4O62-
将上述溶液稀释配制成200mL溶液,请完成下列实验探究.限选试剂:3%H2O2溶液、KSCN溶液、FeCL2溶液、稀硫酸
(4)定量检验海带中的碘含量:
①取20mL稀释后溶液A分别于锥形瓶,分别用酸式滴定管滴加0.01mol/LKMnO4
溶液至溶液刚显浅红色,将I-氧化为I2并得到溶液B
②在溶液B加入两滴淀粉溶液,用0.01mol/LNaS2O3溶液,滴定至终点,终点现象为溶液蓝色刚好褪去,30s内不恢复蓝色,记录数据,重复上测定步骤①、②两次,三次平均消耗Na2S2O3溶液体积为VmL,计算海带中碘元素的百分含量$\frac{1.27V}{a}$×100%.
(假设操作Ⅰ、Ⅱ过程中碘不损失,原子量I-127)

(1)操作Ⅰ为灼烧,则灼烧时用坩埚 盛装海带,操作Ⅱ为过滤
(2)水浸时通常要将悬浊液煮沸2-3min,目的是加快含碘物质在水中的溶解,以使灰烬中的含碘物质尽可能多的进入溶液
(3)操作Ⅲ,是同学们对溶液A中碘元素的存在形式进行的探究实验.
[推测]:①以IO3-形式存在; ②以I-形式存在
[查阅资料]:IO3-具有较强的氧化性,I2+2S2O32-═2I-+S4O62-
将上述溶液稀释配制成200mL溶液,请完成下列实验探究.限选试剂:3%H2O2溶液、KSCN溶液、FeCL2溶液、稀硫酸
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 取少量稀释后的溶液A加入淀粉后再用硫酸酸化,分装于试管Ⅰ、Ⅱ | 无现象 |  |
| ② | 往试管Ⅰ中加入FeCl2溶液后,加入2滴KSCN溶液并振荡 | 无现象 | 证明不是以IO3-形式存在 |
| ③ | 往试管Ⅱ中加入3%H2O2溶液并振荡 | 溶液变蓝 | 证明以I-形式存在 |
①取20mL稀释后溶液A分别于锥形瓶,分别用酸式滴定管滴加0.01mol/LKMnO4
溶液至溶液刚显浅红色,将I-氧化为I2并得到溶液B
②在溶液B加入两滴淀粉溶液,用0.01mol/LNaS2O3溶液,滴定至终点,终点现象为溶液蓝色刚好褪去,30s内不恢复蓝色,记录数据,重复上测定步骤①、②两次,三次平均消耗Na2S2O3溶液体积为VmL,计算海带中碘元素的百分含量$\frac{1.27V}{a}$×100%.
(假设操作Ⅰ、Ⅱ过程中碘不损失,原子量I-127)
12.某溶液经经测定pH=1,溶液中还存在Ba2+、Fe2+,此溶液中还可能大量存在的离子是( )
| A. | SO42- | B. | CO32- | C. | NO3- | D. | Br- |
19.下列各组离子在pH=2溶液中能大量共存的是( )
| A. | K+,HCO3-,Cl-,Na+ | B. | Mg2+,NH4+,Cl-,NO3- | ||
| C. | Ba2+,Cu2+,OH-,Cl- | D. | Na+,SO42-,Cu2+,NO3- |
9.下列微粒的存在最能说明碘可能呈现还原性的是( )
| A. | I- | B. | I2 | C. | I2+ | D. | I${\;}_{3}^{-}$ |
13.关于离子方程式Cu2++2OH-═Cu(OH)2↓的说法正确的是( )
| A. | 可表示所有铜盐和强碱的反应 | |
| B. | 可表示某一个具体的反应,也可以表示一类反应 | |
| C. | 离子方程式中的OH-可代表弱碱或强碱 | |
| D. | 该反应可看到Cu(OH)2白色沉淀 |
 ).请用化学方程式表示其制备过程.
).请用化学方程式表示其制备过程.