题目内容
3.对化学反应的速率和限度的叙述正确的是( )| A. | 增加某一反应物的用量一定能够加快该反应的速率 | |
| B. | 化学反应的限度是不可改变的 | |
| C. | 化学反应进行的时间越长该反应的限度越大 | |
| D. | 化学反应达到限度时,正逆反应速率相等 |
分析 A、增加某一反应中固体物质的用量不能加快反应的速率;
B、改变外界条件的温度、压强、浓度可以引起平衡的移动;
C、化学反应进行到一定的时间可以达到平衡状态,此时物质的转化率不再变化;
D、化学反应达到平衡状态时:正逆反应速率相等.
解答 解:A、增加某一反应中固体物质的用量,不会改变化学反应的速率,故A错误;
B、改变外界条件的温度、压强、浓度可以引起平衡的移动,化学反应的限度是可改变的,故B错误;
C、化学反应进行到一定的时间可以达到平衡状态,时间再长,该反应的转化率不再变化,故C错误;
D、化学反应达到平衡状态时:正逆反应速率相等,故D正确.
故选D.
点评 本题考查了化学反应速率、平衡移动的影响因素知识,注重了基础知识的考查,本题难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.下列有关防止或减少酸雨的措施中不可行的是( )
| A. | 对燃煤及燃煤烟气进行脱硫 | |
| B. | 推广天然气、甲醇等作为汽车的燃料 | |
| C. | 对含SO 2、NO 2的废气处理后再排空 | |
| D. | 人工收集大气雷电产生的氮的氧化物 |
14.在一定温度下,向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)?2Z(g),此反应达到平衡的标志是( )
| A. | v (X)正=v (X)逆=0 | |
| B. | v (X):v (Y)=l:2 | |
| C. | 容器内X、Y、Z的浓度不随时间变化 | |
| D. | 单位时间消耗0.1 molX同时生成0.2molZ |
11.具有下列电子排布式的原子中,半径最大的是( )
| A. | ls22s22p63s23p5 | B. | 1s22s22p3 | C. | 1s22s22sp5 | D. | 1s22s22p63s23p4 |
18.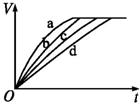 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生气体体积V的数据,根据数据绘制的图如图,则曲线a、b、c、d所对应的实验组别可能是( )
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生气体体积V的数据,根据数据绘制的图如图,则曲线a、b、c、d所对应的实验组别可能是( )
 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生气体体积V的数据,根据数据绘制的图如图,则曲线a、b、c、d所对应的实验组别可能是( )
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生气体体积V的数据,根据数据绘制的图如图,则曲线a、b、c、d所对应的实验组别可能是( )| 组别 | 盐酸的浓度(mol/L) | 温度(℃) | 状态 |
| 1 | 2.0 | 25 | 块状 |
| 2 | 2.5 | 30 | 块状 |
| 3 | 2.5 | 50 | 块状 |
| 4 | 2.5 | 30 | 粉末状 |
| A. | 4-2-3-1 | B. | 1-2-3-4 z | C. | 3-4-2-1 | D. | 1-2-4-3 |
8.X、Y、Z、W、R五种短周期元素原子序数依次增大,X原子是所有原子中半径最小的,Y、R同主族,Z、W、R同周期,Y原子的最外层电子数是次外层的3倍,Z是常见的金属,其氢氧化物能溶于强碱溶液但不溶于氨水,W单质是人类将太阳能转变为电能的常用材料,下列相关说法正确的是( )
| A. | W的最高价氧化物对应的水化物难溶于水 | |
| B. | 原子半径按X、Y、Z、R、W的顺序依次增大 | |
| C. | Z与Y形成的化合物是碱性氧化物 | |
| D. | WY2能与强碱溶液反应,但不能与任何酸反应 |
15.下列实验操作正确且能达到目的是( )
| A. | 用NH4Cl溶液蒸干制备NH4Cl固体 | |
| B. | 用BaCl2溶液鉴别AgNO3溶液和K2SO4溶液 | |
| C. | 用重结晶法除去KNO3中混有的NaCl | |
| D. | 将混有少量氯化氢气体的Cl2通入NaOH溶液中除去氯化氢气体 |
12.四种短周期元素A、B、C、D的原子序数依次增大,其中A与C,B与D同主族.常温下A的单质是密度最小的气体;B的最高正价与最低负价的代数和为0.下列判断正确的是( )
| A. | A、C两种元素组成的化合物CA为共价化合物 | |
| B. | B元素可形成多种同素异形体 | |
| C. | C元素存在多种核素 | |
| D. | D的氧化物是两性氧化物 |
13.选用如图所示仪器中的两个或几个(内含物质)组装成实验装置,以验证木炭可被浓硫酸氧化成CO2,下列说法正确的是( )
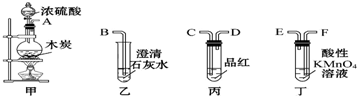

| A. | 按气流从左向右流向,连接装置的正确顺序是A→C→D→F→E→B | |
| B. | 丁中溶液褪色,乙中溶液变浑浊说明甲中生成CO2 | |
| C. | 丙中品红溶液不褪色,乙中溶液变浑浊说明甲中生成CO2 | |
| D. | 丁和丙中溶液都褪色,乙中溶液变浑浊,说明甲中有CO2生成 |