题目内容
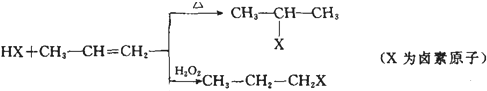
一定条件下存在反应:2SO2(g)+O2(g)═2SO3(g),△H<0.现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,按如图所示投料,并在400℃条件下开始反应.达到平衡时,下列说法正确的是( )


| A、容器Ⅰ、Ⅲ中平衡常数相同 |
| B、容器Ⅱ、Ⅲ中正反应速率相同 |
| C、SO3的体积分数:Ⅱ<Ⅲ |
| D、容器Ⅰ中SO2的转化率与容器Ⅱ中SO3的转化率之和小于1 |
考点:化学平衡的计算
专题:
分析:A、容器Ⅰ是绝热容器,反应过程中温度升高,平衡逆向进行;
B、容器Ⅱ是恒温恒容,Ⅲ是恒压容器,反应过程中随着SO2转化为SO3,容器Ⅱ的压强会增大,反应速率会比容器Ⅲ大;
C、容器Ⅱ是恒温恒容,Ⅲ是恒温恒压,随着反应的进行,容器Ⅱ中压强大于容器Ⅲ,平衡正向进行,三氧化硫含量增大,Ⅱ>Ⅲ;
D、若容器Ⅱ恒温恒容,容器Ⅰ是恒温恒容时,达到相同平衡状态,二氧化硫转化率和三氧化硫转化率之和为1,实际容器Ⅰ是绝热恒容,随着反应的进行,温度升高,平衡逆向进行,二氧化硫转化率减小.
B、容器Ⅱ是恒温恒容,Ⅲ是恒压容器,反应过程中随着SO2转化为SO3,容器Ⅱ的压强会增大,反应速率会比容器Ⅲ大;
C、容器Ⅱ是恒温恒容,Ⅲ是恒温恒压,随着反应的进行,容器Ⅱ中压强大于容器Ⅲ,平衡正向进行,三氧化硫含量增大,Ⅱ>Ⅲ;
D、若容器Ⅱ恒温恒容,容器Ⅰ是恒温恒容时,达到相同平衡状态,二氧化硫转化率和三氧化硫转化率之和为1,实际容器Ⅰ是绝热恒容,随着反应的进行,温度升高,平衡逆向进行,二氧化硫转化率减小.
解答:
解:A、容器Ⅰ是绝热容器,反应过程中温度升高,平衡逆向进行,平衡常数减小,容器Ⅰ、Ⅲ中平衡常数不相同,故A错误;
B、容器Ⅲ是恒压容器,反应过程中压强大于容器Ⅰ,反应速率大,容器Ⅱ、Ⅲ中正反应速率不相同,故B错误;
C、容器Ⅱ是恒温恒容,Ⅲ是恒温恒压,随着反应的进行,容器Ⅱ中压强大于容器Ⅲ,平衡正向进行,三氧化硫含量增大,SO3的体积分数:Ⅱ>Ⅲ,故C错误;
D、若容器Ⅱ恒温恒容,容器Ⅰ也是恒温恒容时,达到相同平衡状态,二氧化硫转化率和三氧化硫转化率之和为1,但实际容器Ⅰ是绝热恒容,随反应进行温度升高,平衡逆向进行,二氧化硫转化率减小,因此容器Ⅰ中SO2的转化率与容器Ⅱ中SO3的转化率之和小于1,故D正确;
故选D.
B、容器Ⅲ是恒压容器,反应过程中压强大于容器Ⅰ,反应速率大,容器Ⅱ、Ⅲ中正反应速率不相同,故B错误;
C、容器Ⅱ是恒温恒容,Ⅲ是恒温恒压,随着反应的进行,容器Ⅱ中压强大于容器Ⅲ,平衡正向进行,三氧化硫含量增大,SO3的体积分数:Ⅱ>Ⅲ,故C错误;
D、若容器Ⅱ恒温恒容,容器Ⅰ也是恒温恒容时,达到相同平衡状态,二氧化硫转化率和三氧化硫转化率之和为1,但实际容器Ⅰ是绝热恒容,随反应进行温度升高,平衡逆向进行,二氧化硫转化率减小,因此容器Ⅰ中SO2的转化率与容器Ⅱ中SO3的转化率之和小于1,故D正确;
故选D.
点评:本题考查了影响化学平衡因素的分析判断,注意容器的条件分析应用,绝热容器使体系温度升高,掌握基础是关键,题目难度中等.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案
相关题目
密闭容器中进行的反应2SO2+O2?2SO3温度保持不变,下列说法中正确的是( )
| A、增加SO2的浓度,正反应速率先增大,后逐渐减小最后保持不变 |
| B、增加O2的浓度,正反应速率逐渐增大 |
| C、增加SO2的浓度,平衡常数增大 |
| D、若平衡时SO2的浓度比原来大,则平衡常数增大 |