题目内容
下列除去杂质的方法正确的是( )
| A、除去氨气中的水蒸气:气体通过装有浓硫酸的洗气瓶 |
| B、除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶 |
| C、除去FeCl2溶液中混有的FeCl3:加入过量铁粉,过滤 |
| D、除去Cu粉中混有的CuO:加适量稀硝酸后,过滤.洗涤 |
考点:物质的分离、提纯的基本方法选择与应用
专题:化学实验基本操作
分析:A.氨气与浓硫酸反应;
B.二氧化碳和二氧化硫都与饱和碳酸钠溶液反应;
C.FeCl3可与铁粉反应生成FeCl2;
D.Cu、CuO都与硝酸反应.
B.二氧化碳和二氧化硫都与饱和碳酸钠溶液反应;
C.FeCl3可与铁粉反应生成FeCl2;
D.Cu、CuO都与硝酸反应.
解答:
解:A.氨气与浓硫酸反应,应用碱石灰干燥,故A错误;
B.二氧化碳和二氧化硫都与饱和碳酸钠溶液反应,应用饱和碳酸氢钠溶液除杂,故B错误;
C.FeCl3可与铁粉反应生成FeCl2,可除去杂质,故C正确;
D.Cu、CuO都与硝酸反应,应用稀硫酸或盐酸除杂,故D错误.
故选C.
B.二氧化碳和二氧化硫都与饱和碳酸钠溶液反应,应用饱和碳酸氢钠溶液除杂,故B错误;
C.FeCl3可与铁粉反应生成FeCl2,可除去杂质,故C正确;
D.Cu、CuO都与硝酸反应,应用稀硫酸或盐酸除杂,故D错误.
故选C.
点评:本题考查物质的分离、提纯,为高考常见题型,侧重于考查学生的分析能力和实验能力,注意把握物质的性质的异同,注意除杂时不能引入新的杂质.

练习册系列答案
相关题目
在体积为2L的恒容密闭容器中发生反应xA(g)+yB(g)?zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A)n(B)的变化关系.则下列结论正确的是( )


| A、200℃时,反应从开始到平衡的平均速率v(B)=0.04mol?L-1?min-1 |
| B、图Ⅱ所知反应xA(g)+yB(g)?zC(g)的△H<0,且a=2 |
| C、若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆) |
| D、200℃时,向容器中充入2 mol A 和1 mol B,达到平衡时,A 的体积分数小于50% |
与I2<Br2<Cl2<F2的变化规律(由弱到强或由低到高或由难到易)不符合的是( )
| A、与氢气反应的难易程度 |
| B、氧化性的强弱 |
| C、氢化物的熔沸点 |
| D、氢化物稳定性 |
根据热化学方程式:S(g)+O2(g)?SO2(g)△H=-QkJ?mol-1(Q>0),下列分析正确的是( )
| A、1mol S(g)与1mol O2(g)反应生成1mol SO2(g)放出QkJ的热量 |
| B、1个S(g)与1个O2(g)完全反应要放出Q kJ的热量 |
| C、S(s)+O2(g)?SO2(g)△H<-Q kJ?mol-1 |
| D、1mol S(g)与1mol O2(g)的总能量比1mol SO2(g)的总能量低Q kJ |
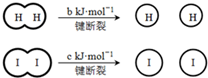 H2和I2在一定条件下能发生反应:H2(g)+I2(g)═2HI(g)△H=-a kJ?mol-1已知:(a、b、c均大于零)下列说法不正确的是( )
H2和I2在一定条件下能发生反应:H2(g)+I2(g)═2HI(g)△H=-a kJ?mol-1已知:(a、b、c均大于零)下列说法不正确的是( )| A、若b>c则相同条件下H2比I2稳定 |
| B、断开1mol H-H键和1mol I-I键所需能量大于断开2mol H-I键所需能量 |
| C、断开2mol H-I键所需能量约为(c+b+a)kJ |
| D、向密闭容器中加入1mol H2和2mol I2,充分反应后放出的热量小于2akJ |
A、B、C、D、E为五种短周期元素,原子序数依次递增.其中A、C、E为连续三个周期的元素,B、E同族,C最外层电子数是D最外层电子数的3倍,A、B、C、D、E的最外层电子数之和为17.下列说法正确的是( )
| A、原子半径:D>E>C>B>A |
| B、E的氧化物熔点很高,是由于其相对分子质量大 |
| C、D的单质能与B的氧化物发生置换反应 |
| D、由A、B、C元素组成的物质只有一种 |
某醇烯酸是合成香精的主要原料,其结构简式为: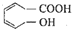 下列有关该醇烯酸的叙述正确的是( )
下列有关该醇烯酸的叙述正确的是( )
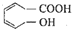 下列有关该醇烯酸的叙述正确的是( )
下列有关该醇烯酸的叙述正确的是( )| A、该醇烯酸的分子式为C7H8O3 |
| B、既可以通过加聚反应形成高分子,也可以通过缩聚反应形成高分子 |
| C、不能使酸性高锰酸钾溶液褪色 |
| D、分子内能形成六元环的酯 |
下列有关物质性质的应用正确的是( )
| A、液氨汽化时要放出大量的热,可用作制冷剂 |
| B、二氧化硫可广泛用于食品的漂白 |
| C、生石灰能与水反应,可用来干燥氯气 |
| D、氧化铝是一种电解质,可用于制铝 |