题目内容
将3.2g铜加入足量的20ml浓硫酸中加热,充分反应.
(1)反应中最多可以收集到标准状况下的气体多少L?
(2)反应中消耗硫酸的总物质的量是多少mol?
(3)若将反应后的混合溶液加水稀释到100mL时,测得H+的物质的量浓度5.2mol/L.
则原浓硫酸的物质的量浓度是多少mol/L?
(1)反应中最多可以收集到标准状况下的气体多少L?
(2)反应中消耗硫酸的总物质的量是多少mol?
(3)若将反应后的混合溶液加水稀释到100mL时,测得H+的物质的量浓度5.2mol/L.
则原浓硫酸的物质的量浓度是多少mol/L?
考点:化学方程式的有关计算
专题:计算题
分析:(1)(2)根据n=
计算3.2gCu的物质的量,再根据方程式Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O计算;
(3)反应后的混合溶液为稀硫酸和硫酸铜的混合液,加水稀释到100mL时,测得H+的物质的量浓度5.2mol/L,根据n=cv可求得剩余氢离子的物质的量,根据n(H2SO4)=
n(H+),求得剩余的硫酸,原浓硫酸的物质的量为(3)(2)中硫酸的数据和,根据c=
计算原浓硫酸的物质的量浓度;
| m |
| M |
| ||
(3)反应后的混合溶液为稀硫酸和硫酸铜的混合液,加水稀释到100mL时,测得H+的物质的量浓度5.2mol/L,根据n=cv可求得剩余氢离子的物质的量,根据n(H2SO4)=
| 1 |
| 2 |
| n |
| v |
解答:
解:(1)(2)3.2gCu的物质的量=
=0.05mol,由方程式Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O可知,反应消耗的H2SO4的物质的量=2n(Cu)=2×0.05mol=0.1mol,生成SO2的物质的量=n(Cu)=0.05mol,故生成SO2的体积=0.05mol×22.4L/mol=1.12L,
(1)答:反应中最多可以收集到标准状况下的气体为1.12L;
(2)答:反应中消耗硫酸的总物质的量是0.1mol;
(3)反应后的混合溶液为稀硫酸和硫酸铜的混合液,加水稀释到100mL时,测得H+的物质的量浓度5.2mol/L,剩余的硫酸n(H2SO4)=
n(H+)=
×cv=
×5.2mol/L×0.1L=0.26mol,原浓硫酸的物质的量为0.26mol+0.1mol=0.36mol,则原浓硫酸的物质的量浓度c=
=
=18mol/L,
答:原浓硫酸的物质的量浓度是18mol/L;
| 3.2g |
| 64g/mol |
| ||
(1)答:反应中最多可以收集到标准状况下的气体为1.12L;
(2)答:反应中消耗硫酸的总物质的量是0.1mol;
(3)反应后的混合溶液为稀硫酸和硫酸铜的混合液,加水稀释到100mL时,测得H+的物质的量浓度5.2mol/L,剩余的硫酸n(H2SO4)=
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| n |
| v |
| 0.36mol |
| 0.02L |
答:原浓硫酸的物质的量浓度是18mol/L;
点评:本题考查根据方程式进行的计算,题目难度不大,注意Cu与稀硫酸不反应,(3)注意根据氢与硫元素关系进行解答.

练习册系列答案
相关题目
在考古工作中用的较多的是13C、15N的分析方法.下列关于13C、15N的叙述正确的是( )
| A、13C与15N具有相同的中子数 |
| B、C60、13C和石墨互为同素异形体 |
| C、等物质的量的13C17O、15N2两种气体具有相同的质子数和原子数 |
| D、13C、15N和C60、N70互为同位素 |
对于相同质量的SO2和SO3,下列说法:①硫元素的质量比为5:4 ②分子数之比为5:4③原子总数之比为15:16④同温同压下的两种气体体积之比为5:4.其中正确的是( )
| A、①②③④ | B、①②④ |
| C、只有③ | D、其它组合 |
下列物质中,不互为同素异形体的是( )
| A、金刚石、石墨 |
| B、红磷、白磷 |
| C、二氧化硫和三氧化硫 |
| D、斜方硫、单斜硫 |
下列反应所产生的气体体积在标准状况下为22.4L的是( )
| A、将2mol金属Cu与含2molH2SO4的浓硫酸共热 |
| B、将1 mol MnO2固体与含4molHCl的浓盐酸共热 |
| C、常温下,将32.2g金属钠和5.4g金属铝同时投入到足量水中 |
| D、常温下,将10.8g的Al和22.4g的Fe投入到300g 98%的硫酸中 |
下列操作中,溶液的颜色不会发生变化的是( )
| A、在硅酸钠溶液中滴加酚酞 |
| B、碳酸钠溶液中滴加酚酞 |
| C、硫酸铁溶液中滴加硫氰化钾溶液 |
| D、碳酸氢钠溶液中滴加稀盐酸 |
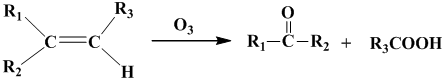
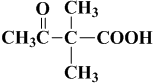
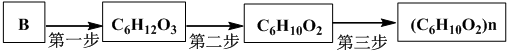

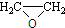 ).写出以邻甲基苯酚(
).写出以邻甲基苯酚(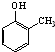 )和乙醇为原料制备
)和乙醇为原料制备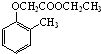 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).