题目内容
13.0.1mol某金属单质与足量的盐酸反应,放出1.12LH2(标准状况),并转变为具有Ar原子的电子层结构的离子,该金属元素在元素周期表中的位置是( )| A. | 第三周期第IA族 | B. | 第四周期第IA族 | C. | 第三周期第ⅡA族 | D. | 第四周期第ⅡA族 |
分析 0.1mol某金属单质与足量的硫酸溶液反应,放出1.12LH2(标准状况),设金属元素在化合物中的化合价为x,由电子守恒可知0.1mol×(x-0)=$\frac{1.12L}{22.4L/mol}$×2×(1-0),解得x=1,并转变为具有Ar原子的电子层结构的离子,则质子数为18+1=19,即为K,以此来解答.
解答 解:0.1mol某金属单质与足量的硫酸溶液反应,放出1.12LH2(标准状况),设金属元素在化合物中的化合价为x,
由电子守恒可知:0.1mol×(x-0)=$\frac{1.12L}{22.4L/mol}$×2×(1-0),解得:x=1,
该金属反应后转变为具有Ar原子的电子层结构的离子,则质子数=18+1=19,为K元素,
K的原子序数为19,位于周期表中第四周期第IA族,
故选B.
点评 本题考查元素周期表结构及应用,为高频考点,把握电子守恒计算元素的化合价为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
1.仪器名称为“蒸馏烧瓶”的是( )
| A. |  | B. |  | C. |  | D. |  |
4.石油裂解的目的是( )
| A. | 提高轻质液体燃料的产量 | B. | 主要提高汽油的产量 | ||
| C. | 改善汽油的质量 | D. | 获得短链不饱和烃 |
8.下列对应关系正确的是( )
| A. | 淀粉(C6H10O5)n]与纤维素(C6H10O5)n]互为同分异构体 | |
| B. | C3H6与 C2H4互为同系物 | |
| C. | TD与H2化学性质几乎相同 | |
| D. | H2O与D2O是不同核素 |
18.将淀粉浆和淀粉酶的混合物放入半透膜袋中,扎好袋口浸入流动的温水中.经过足够长的时间后,取出袋内的液体,分别与:①碘水、②新制Cu(OH)2加热、③浓硝酸(微热)作用,其现象依次是( )
| A. | 显蓝色;无红色沉淀;显黄色 | B. | 显蓝色;有红色沉淀;不显黄色 | ||
| C. | 不显蓝色;无红色沉淀;显黄色 | D. | 不显蓝色;无红色沉淀;不显黄色 |
5.砹(At)是卤族元素的第五个成员,下列关于砹的叙述不正确的是( )
| A. | 砹位于第六周期第VIIA族 | B. | 砹单质的氧化性比碘强 | ||
| C. | 还原性:At->I- | D. | 稳定性:HAt>HI |
3.现有三组溶液:①汽油和氯化钠溶液 ②70%的乙醇溶液 ③氯化钠和单质碘的水溶液,分离以上各混合液的正确方法依次是( )
| A. | 分液、蒸馏、萃取 | B. | 萃取、蒸馏、分液 | C. | 分液、萃取、蒸馏 | D. | 蒸馏、萃取、分液 |
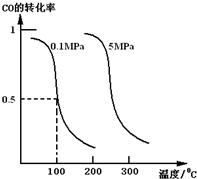 研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题.在催化剂作用下,CO可用于合成甲醇:CO(g)+2H2(g)?CH3OH(g).
研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题.在催化剂作用下,CO可用于合成甲醇:CO(g)+2H2(g)?CH3OH(g).