题目内容
5.砹(At)是卤族元素的第五个成员,下列关于砹的叙述不正确的是( )| A. | 砹位于第六周期第VIIA族 | B. | 砹单质的氧化性比碘强 | ||
| C. | 还原性:At->I- | D. | 稳定性:HAt>HI |
分析 砹是卤族元素的第五个成员,则位于周期表中砹位于第六周期第VIIA族;在卤族元素中,砹的金属性最强,非金属性最弱,结合同周期元素性质的相似性和递变性分析该题.
解答 解:A.砹(At)是卤族元素的第五个成员,则At最外层含有7个电子、6个电子层,位于第六周期第VIIA族,故A正确;
B.同一主族中,原子序数越大,单质的氧化性越弱,则At的氧化性比碘单质弱,故B错误;
C.非金属性越强,离子的还原性越弱,非金属性At<I,则阴离子的还原性At->I-,故C正确;
D.非金属性越强,氢化物的稳定性越强,非金属性At<I,则氢化物稳定性:HAt>HI,故D正确;
故选B.
点评 本题考查原子结构与元素周期律的关系及应用,题目难度中等,可根据元素周期律来确定未知元素及其化合物的性质,采用知识迁移的方法进行解答,试题侧重考查学生的灵活应用能力.

练习册系列答案
相关题目
13.在一定温度和压强下,2L气体XY2与1L气体Y2化合,生成2L气体化合物,则该化合物的化学式为( )
| A. | X3Y | B. | X3Y2 | C. | X2Y3 | D. | XY3 |
16.镁铝性质相似,下表中对两者的对比不正确的是( )
| 选项 | 反应 | 铝 | 镁 |
| A | 与非金属 | 能被Cl2、O2氧化 | 能与N2、O2反应 |
| B | 与水 | 能与沸水反应 | 反应很困难 |
| C | 与碱 | 能溶于强碱溶液 | 不反应 |
| D | 与某些氧化物 | 能与Fe2O3、MnO2、Cr2O3等 金属氧化物发生铝热反应 | 能在CO2中燃烧 |
| A. | A | B. | B | C. | C | D. | D |
13.0.1mol某金属单质与足量的盐酸反应,放出1.12LH2(标准状况),并转变为具有Ar原子的电子层结构的离子,该金属元素在元素周期表中的位置是( )
| A. | 第三周期第IA族 | B. | 第四周期第IA族 | C. | 第三周期第ⅡA族 | D. | 第四周期第ⅡA族 |
20.分枝酸可用于生化研究,其结构简式如图.下列关于分枝酸的叙述正确的是( )
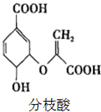

| A. | 分枝酸的分子式为C10H8O6 | |
| B. | 分枝酸能发生取代、加成、氧化反应 | |
| C. | 1mol分枝酸最多可与3molNaOH发生中和反应 | |
| D. | 1mol分枝酸最多可与2molBr2发生反应 |
10.下列与金属腐蚀有关的说法,正确的是( )


| A. | 图1中,插入海水中的铁棒,越靠近底端腐蚀越严重 | |
| B. | 图2中,正极附近无明显现象 | |
| C. | 图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀 | |
| D. | 图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极 |
17.下列说法正确的是(NA为阿伏加德罗常数)( )
| A. | 在1mol甲基(-CH3)中,电子总数9NA | |
| B. | 在1mol的Na2O2中,有2NA个阴离子 | |
| C. | 标准状况下,22.4L CHC13所含有的分子数目为NA | |
| D. | Cu、A1为电极,浓硝酸为电解质溶液所构成的原电池中,导线上流过NA个电子,则A1电极放出气体的体积一定为22.4L |
14.如图所示高聚物的单体有几种( )


| A. | 2 | B. | 3 | C. | 4 | D. | 5 |