题目内容
1.学习科学知识可以指导生活实践,某课外学习小组对日常生活中不可缺少的调味品M进行探究.已知C可在D中燃烧发出苍白色火焰.M与其他物质的转化关系如图1所示(部分产物已略去):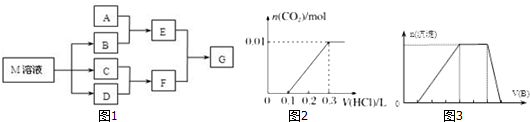
(1)若A是一种常见的酸性氧化物,且可用于制造玻璃,E溶液与F溶液反应可以制备一种胶体,则E溶液
的 俗称是水玻璃
(2)若A是CO2气体,A与B溶液能够反应,反应后所得的溶液再与盐酸反应,如图2所示,则A与B溶液反应
后溶液中的溶质化学式为NaHCO3、Na2CO3.
(3)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F加入E溶液中,所发生反应的离子方程式是AlO2-+4H+=Al3++2H2O.
(4)若A是一种溶液,只可能含有H+、NH4+、Mg2+、Fe3+、Al3+、CO32-、SO42-中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图3所示,由此可知该溶液中肯定含有的离子及其浓度之比为c(H+):c(Al3+):c(NH4+):c(SO42-)=1:1:2:3.
(5)含FeO42-的化合物可作为一种“绿色高效多功能”水处理剂,在B存在的条件下可由FeCl3和NaClO反应制得,其反应的离子方程式为3ClO-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O.
分析 C可在D中燃烧发出苍白色火焰,为氢气与氯气反应生成HCl,可推知C为H2、D为Cl2、F为HCl,M是日常生活中不可缺少的调味品,M的溶液电解生成氢气、氯气与B,可推知M为NaCl、B为NaOH,
(1)若A是一种常见的酸性氧化物,且可用于制造玻璃,则A为SiO2,E为Na2SiO3,E与F溶液反应可以制备G为H2SiO3;
(2)曲线中,从0.1L~0.3L发生反应NaHCO3+HCl=NaCl+CO2↑+H2O,该阶段消耗盐酸为200mL,而开始产生二氧化碳时消耗盐酸为100mL,小于200mL,所以溶液中的溶质成分NaHCO3、Na2CO3;
(3)若A是一种常见金属单质,且与NaOH溶液能够反应,则A为Al,E为NaAlO2,则将过量的HCl溶液加入NaAlO2溶液中反应生成铝盐;
(4)由图可知,开始加入NaOH没有沉淀和气体产生,则一定有H+,一定没有CO32-,后来有沉淀产生且最后消失,则一定没有Mg2+、Fe3+,一定含有Al3+;中间段沉淀的质量不变,应为NH4++OH-=NH3•H2O的反应,则含有NH4+,由电荷守恒可知一定含有SO42-,根据各阶段消耗的NaOH体积结合离子方程式计算n(H+):n(Al3+):n(NH4+)之比,再结合电荷守恒计算与n(SO42-)的比例关系,据此计算;
(5)在NaOH存在的条件下可由FeCl3和NaClO反应制得FeO42-,根据电子得失守恒和元素守恒书写离子方程式.
解答 解:C可在D中燃烧发出苍白色火焰,为氢气与氯气反应生成HCl,可推知C为H2、D为Cl2、F为HCl,M是日常生活中不可缺少的调味品,M的溶液电解生成氢气、氯气与B,可推知M为NaCl、B为NaOH,
(1)若A是一种常见的酸性氧化物,且可用于制造玻璃,则A为SiO2,E为Na2SiO3,与F溶液反应可以制备G为H2SiO3,E溶液的俗称是水玻璃,
故答案为:水玻璃;
(2)假设溶质为碳酸钠,则前后消耗盐酸的体积应相等,而曲线中,从0.1L~0.3L发生反应NaHCO3+HCl=NaCl+CO2↑+H2O,该阶段消耗盐酸为200mL,而开始产生二氧化碳时消耗盐酸为100mL,小于200mL,所以溶液中的溶质成分NaHCO3、Na2CO3,
故答案为:NaHCO3、Na2CO3;
(3)若A是一种常见金属单质,且与NaOH溶液能够反应,则A为Al,E为NaAlO2,则将过量的HCl溶液加入NaAlO2溶液中,所发生反应的离子方程式是:AlO2-+4H+=Al3++2H2O,
故答案为:AlO2-+4H+=Al3++2H2O;
(4)由图可知,开始加入NaOH没有沉淀和气体产生,则一定有H+,一定没有CO32-,后来有沉淀产生且最后消失,则一定没有Mg2+、Fe3+,一定含有Al3+;中间段沉淀的质量不变,应为NH4++OH-=NH3•H2O的反应,则含有NH4+,由电荷守恒可知一定含有SO42-,发生反应H++OH-=H2O,氢离子消耗NaOH溶液的体积为1体积,发生反应Al3++3OH-=Al(OH)3↓,铝离子消耗NaOH溶液的体积为3体积,发生反应NH4++OH-=NH3•H2O,铵根消耗氢氧化钠为2体积,则n(H+):n(Al3+):n(NH4+)=1:1:2,由电荷守恒可知,n(H+):n(Al3+):n(NH4+):n(SO42-)=1:1:2:3,故c(H+):c(Al3+):c(NH4+):c(SO42-)=1:1:2:3,
故答案为:c(H+):c(Al3+):c(NH4+):c(SO42-)=1:1:2:3;
(5)在NaOH存在的条件下可由FeCl3和NaClO反应制得FeO42-,反应的离子方程式为3ClO-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O,
故答案为:3ClO-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O.
点评 本题考查无机物推断等,题目涉及元素化合物较多,需要学生全面掌握据基础知识,(4)中根据图象中的平台确定含有铵根离子是关键,注意离子方程式与电荷守恒的应用,难度中等.

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案| A. | CH≡CH 和  | B. | 甲醚和乙醇 | C. | 环丙烷和环己烷 | D. |  和 和 |
①硅酸钠可用于制备木材防火剂
②硅是构成一些岩石和矿物的基本元素
③高纯度的硅单质广泛用于制作光导纤维
④陶瓷,水晶,玻璃等是人类应用很早的硅酸盐材料.
| A. | ①② | B. | ①③ | C. | ②④ | D. | ③④ |
| 选项 | 反应 | 铝 | 镁 |
| A | 与非金属 | 能被Cl2、O2氧化 | 能与N2、O2反应 |
| B | 与水 | 能与沸水反应 | 反应很困难 |
| C | 与碱 | 能溶于强碱溶液 | 不反应 |
| D | 与某些氧化物 | 能与Fe2O3、MnO2、Cr2O3等 金属氧化物发生铝热反应 | 能在CO2中燃烧 |
| A. | A | B. | B | C. | C | D. | D |
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是b.
a.原子半径和离子半径均减小
b.金属性减弱,非金属性增强
c.氧化物对应的水化物碱性减弱,酸性增强d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为氩,氧化性最弱的简单阳离子是(填离子符号)Na+.
(3)已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
②制铝时,电解Al2O3而不电解AlCl3的原因是氯化铝是共价化合物,熔融态氯化铝难导电; ③写出电解Al2O3反应方程式2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$+4Al+3O2↑.
| A. | 第三周期第IA族 | B. | 第四周期第IA族 | C. | 第三周期第ⅡA族 | D. | 第四周期第ⅡA族 |

| A. | 图1中,插入海水中的铁棒,越靠近底端腐蚀越严重 | |
| B. | 图2中,正极附近无明显现象 | |
| C. | 图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀 | |
| D. | 图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极 |
| A. |  与 与 是同分异构体 是同分异构体 | |
| B. | 苯可以发生加成反应 | |
| C. | 可通过萃取的方法,从煤中提取苯 | |
| D. | 向2mL苯中加入1mL酸性高锰酸钾溶液,震荡后静置,可观察到液体分层,上层呈紫红色 |
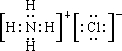 .
.