题目内容
10. 工业上设计用CO2来生产燃料甲醇,既减少二氧化碳气体,又得到宝贵的能源物质.为了探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1molCO2和3molH2,某温度下发生反应:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-49.0KJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示
工业上设计用CO2来生产燃料甲醇,既减少二氧化碳气体,又得到宝贵的能源物质.为了探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1molCO2和3molH2,某温度下发生反应:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-49.0KJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示(1)该反应该温度下,化学平衡常数的值为5.33
(2)下列说法中能作为反应达到平衡状态标志的是ABD(填字母).
A.容器内压强不再发生变化
B.平均相对分子质量不再变化
C.c(CO2)和c(H2)之比等于1:3
D.相同时间内每断裂3molH-H键,同时断裂3molO-H键
(3)下列措施中能使$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$减小的是D
A.再充入1molCO2和3molH2 B.将H2O(g)从体系中分离
C.充入He(g),使体系压强增大 D.升高温度.
分析 (1)根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积计算;
(2)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(3)要使$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$增大,应使平衡向逆反应方向移动;
解答 解:(1)图象中得到平衡状态二氧化碳浓度为0.25mol/L,甲醇浓度为0.75mol/L,利用化学平衡三行计算方法得到,
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),
开始(mol/L):1 3 0 0
变化(mol/L):0.75 2.25 0.75 0.75
平衡(mol/L):0.25 0.75 0.75 0.75
平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,则K=$\frac{[C{H}_{3}OH][{H}_{2}O]}{[C{O}_{2}][{H}_{2}]^{3}}$=$\frac{0.75×0.75}{0.25×0.7{5}^{3}}$=5.33,
故答案为:5.33;
(2)CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-49.0KJ/mol,反应是气体体积减小的放热反应,
A.反应前后气体物质的量变化,当容器内压强不再发生变化,说明反应达到平衡状态,故A正确;
B.反应前后气体物质的量变化,气体质量不变,若平均相对分子质量不再变化,说明反应达到平衡状态,故B正确;
C.c(CO2)和c(H2)之比等于1:3是反应之比,不能说明正逆反应速率相同,故C错误;
D.生成物中H-O键不是一种物质中的化学键,甲醇和水分子中H-O键一定是1:2,依据化学方程式可知相同时间内每断裂3molH-H键,同时断裂3molO-H键,能说明正逆反应速率相同,故D正确;
故选ABD.
(3)要使$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$减小,应使平衡向逆反应方向移动,
A.再充入1mol CO2和3mol H2,增大反应物浓度,平衡向正反应方向移动,则比值增大,故A错误;
B.将H2O(g)从体系中分离,平衡向正反应方向移动,比值增大,故B错误;
C.充入He(g),使体系压强增大,但对反应物质来说,浓度没有变化,平衡不移动,比值不变,故C错误;
D.因正反应放热,升高温度平衡向逆反应方向移动,则比值减小,故D正确;
故答案为:D;
点评 本题考查了化学平衡常数的计算,化学平衡状态的判断,影响化学平衡的因素,注意当反应达到平衡状态时,正逆反应速率相等,但不为0,题目难度中等.

| A. | 用碱式滴定管量取25.03mLH2SO4溶液 | |
| B. | 用50mL量筒量取21.48mL稀硫酸 | |
| C. | 用pH试纸测定HNO3溶液的pH=3.7 | |
| D. | 用托盘天平称取11.7gNaCl |
| A. | 在船舶的外壳装上镁合金或锌块保护钢铁设备被称为牺牲阳极的阴极保护法 | |
| B. | 赤潮、白色污染、绿色食品中的“赤”“白”“绿”均指相关物质的颜色 | |
| C. | 海水淡化的方法主要有:蒸馏法、电渗析法、离子交换法等 | |
| D. | 乙烯的产量可以用来衡量一个国家的石油化工发展水平 |
| A. | 向含3mol次氯酸钠溶液中通入1mol二氧化硫:3ClO-+H2O+SO2═2HClO+SO4-+Cl- | |
| B. | 向碳酸氢钠溶液中加入过量氢氧化钙溶液2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- | |
| C. | 氢氧化钡溶液与硫酸溶液反应得到中性溶液Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 50mL1mol/L的FeI2溶液中通入0.05molCl2:2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- |
| A. | 钾原子 | B. | 钾离子 | C. | 钾元素 | D. | 钾的化合物 |
| A. | NaHSO4在熔融状态下的电离方程式为NaHSO4═Na++H++SO42- | |
| B. | H2CO3是弱酸,故Na2CO3是弱电解质 | |
| C. | Fe3O4俗称铁红,常用作红色油漆和涂料 | |
| D. | 2.4 g Mg无论与O2还是与N2完全反应转移的电子数均为0.2NA |
| A. | M与X可形成两种常见的共价化合物,与W可形成两种常见的离子化合物 | |
| B. | Y的氢化物的沸点低于Z的氢化物的沸点 | |
| C. | Z的氢化物结合H+的能力强于M的氢化物结合H+的能力 | |
| D. | Z、M、W形成的简单离子,其半径大小W>Z>M |
| A. | 2N2(g)+O2(g)═2N2O(g)△H=+163 kJ•mol-1 | |
| B. | Fe(s)+$\frac{3}{2}$Cl2(g)═FeCl3(s)△H=-138 kJ•mol-1 | |
| C. | 2HgO(s)═2Hg(l)+O2(g)△H=+182 kJ•mol-1 | |
| D. | H2O2(l)═$\frac{1}{2}$O2(g)+H2O(l)△H=-98 kJ•mol-1 |
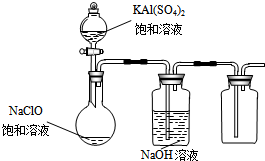 NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业.
NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业.