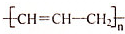题目内容
2.下列说法正确的是( )| A. | NaHSO4在熔融状态下的电离方程式为NaHSO4═Na++H++SO42- | |
| B. | H2CO3是弱酸,故Na2CO3是弱电解质 | |
| C. | Fe3O4俗称铁红,常用作红色油漆和涂料 | |
| D. | 2.4 g Mg无论与O2还是与N2完全反应转移的电子数均为0.2NA |
分析 A.硫酸氢钠熔融状态下只破坏离子键;
B.碳酸钠能够完全电离;
C.Fe3O4是黑色固体;
D.镁原子最外层电子2个,镁失去最外层2个电子形成稳定结构.
解答 解:A.NaHSO4在熔融状态下的电离方程式为:NaHSO4═Na++HSO4-,故A错误;
B.碳酸钠能够完全电离属于强电解质,故B错误;
C.Fe3O4是黑色固体,Fe2O3俗称铁红,常用作红色油漆和涂料,故C错误;
D.镁为2价金属,2.4g镁的物质的量为0.1mol,完全反应0.1mol镁会失去0.2mol电子,故D正确;
故选:D.
点评 本题考查了电解质电离方程式的书写、元素化合物性质、阿伏伽德罗常数的应用,题目难度不大,掌握基础是解题关键.

练习册系列答案
相关题目
12.向50mL12mol/L浓硝酸中加入足量的铜片,充分反应后,被还原的硝酸的物质的量说法准确的是( )
| A. | 等于0.6mol | B. | 等于0.15mol | ||
| C. | 介于0.15mol与0.3mol之间 | D. | 等于0.3mol |
17.根据有机化合物的命名原则,下列命名不正确的是( )
| A. | 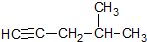 :4-甲基-1-戊炔 :4-甲基-1-戊炔 | B. | CH3CH(CH3)CH=CHCH3:2-甲基-3-戊烯 | ||
| C. | 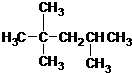 :2,2,4-三甲基戊烷 :2,2,4-三甲基戊烷 | D. |  :间二硝基苯 :间二硝基苯 |
14.将一定量的Na2O2和NaHCO3混合后,在密闭容器中加热充分反应,排出气体,冷却后有固体物质剩余,下列选项不正确的是( )
| Na2O2/mol | NaHCO3/mol | 剩余固体成分 | |
| A | 1 | 2 | Na2CO3 |
| B | 1.5 | 2 | Na2O2Na2CO3 |
| C | 2 | 1 | Na2CO3、NaOH、Na2O2 |
| D | 2 | 2 | NaOH、Na2CO3 |
| A. | A | B. | B | C. | C | D. | D |
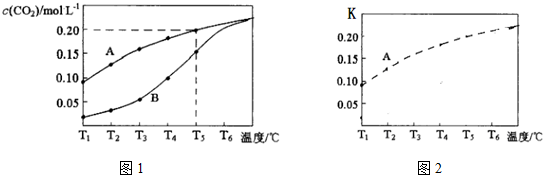
 工业上设计用CO2来生产燃料甲醇,既减少二氧化碳气体,又得到宝贵的能源物质.为了探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1molCO2和3molH2,某温度下发生反应:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-49.0KJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示
工业上设计用CO2来生产燃料甲醇,既减少二氧化碳气体,又得到宝贵的能源物质.为了探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1molCO2和3molH2,某温度下发生反应:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-49.0KJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示