题目内容
1. (1)某温度时,在3L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如下图所示.由图中数据分析:
(1)某温度时,在3L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如下图所示.由图中数据分析:①该反应的化学方程式:Y+2Z?3X
②反应开始至2min末,X的反应速率为$\frac{1}{15}$mol/(L•min).
③该反应是由正逆反应同时开始反应的.(填“正反应”、“逆反应”或“正、逆反应同时”)
(2)在100℃时,将0.100mol N2O4气体充入1L恒容抽空的密闭容器中,隔一定时间对该容器内物质的浓度进行分析得到如表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| c(N2O4)/mol•L-1 | 0.100 | c1 | 0.050 | c3 | c4 |
| c(NO2)/mol•L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
c3=c4(填“>”、“<”或“=”).
②在上述条件下,从反应开始直至达到化学平衡时,N2O4的平均反应速率为0.001mol•L-1•s-1.
③达平衡后下列条件的改变可使NO2气体浓度增大的是B(填字母序号).
A.扩大容器的容积 B.再充入一定量的N2O4
C.分离出一定量的NO2 D.再充入一定量的He
④若在相同条件下,起始时只充入0.080mol NO2气体,则达到平衡时NO2气体的转化率为25%.
分析 (1)①随反应进行,反应物的物质的量减小,生成物的物质的量增加,反应最后反应物的物质的量为定值不为0,说明是可逆反应,根据物质的量变化量之比等于化学计量数之比,据此写出反应方程式;
②根据v=$\frac{△c}{△t}$计算v(X);
③由图可知,反应开始反应混合物Y、Z、X物质的量分别为1.2mol、2.0mol、0.4mol,所以反应从正逆反应同时开始;
(2)①平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,根据方程式计算c2、c1,据此解答;60s后反应达平衡,反应混合物各组分的浓度不变;
②由表可知,60s时反应达平衡,根据方程式计算△c(N2O4),依据化学反应速率V=$\frac{△c}{△t}$计算得到;
③依据化学平衡原理分析改变条件提高NO2转化率的选项;
④依据平衡浓度计算平衡常数,结合化学平衡三段式列式计算,转化率=$\frac{消耗量}{起始量}$×100%.
解答 解:(1)①由图可知,X的物质的量增加为生成物,Y、Z的物质的量减少为反应物,反应最后反应物的物质的量为定值不为0,是可逆反应,
Y、Z、X的物质的量变化量之比为(1.2-1.0)mol:(2.0-1.6)mol:(1.0-0.4)mol=1:2:3,物质的量变化量之比等于化学计量数之比,所以反应方程式为Y+2Z?3X,
故答案为:Y+2Z?3X;
②2min内,X的反应速率为v(X)=$\frac{\frac{0.8mol-0.4mol}{3L}}{2min}$=$\frac{1}{15}$mol/(L•min),
故答案为:$\frac{1}{15}$mol/(L•min);
③由图可知,反应开始反应混合物Y、Z、X物质的量分别为1.2mol、2.0mol、0.4mol,所以反应从正逆反应同时开始,
故答案为:正逆反应同时;
(2)①N2O4(g)?2NO2(g),反应的平衡常数K=$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$;
20s时c(NO2)=0.060mol/L
N2O4?2 NO2,
浓度变化 0.030mol 0.060mol/L
c1=0.10mol/L-0.03mol/L=0.070mol/L;
由表可知,40s时,c(N2O4)=0.050mol/L,
N2O4?2 NO2,
浓度变化:(0.1-0.05)mol/L 0.10mol/L
所以c2=0.10mol/L
所以c2>c1;
故答案为:$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$;<;=;
②由表可知,60s时反应达平衡,c(NO2)=0.120mol/L,
N2O4?2 NO2,
浓度变化:0.06mol/L 0.120mol/L
V(N2O4)=$\frac{0.060mol/L}{60s}$=0.001mol/(L•s);
故答案为:0.001;
③N2O4=2 NO2 反应是气体体积减小的放热反应,依据化学平衡原理分析选项,增大二氧化氮浓度的条件;
A、增大容器体积,各组分浓度均减小,故A错误;
B、再充入四氧化二氮,平衡正向移动,二氧化氮浓度增大,故B正确;
C、减小NO2的浓度,平衡虽正向进行,但二氧化氮的浓度减小,故C错误;
D、再充入一定量的He,总压增大,气体分压不变,平衡不变,二氧化氮浓度不变,故D错误;
故答案为:B;
④依据平衡浓度计算平衡常数,结合化学平衡三段式列式计算;
N2O4?2 NO2,
起始量(mol/L) 0.10 0
变化量(mol/L) 0.06 0.12
平衡量(mol/L) 0.04 0.12
K=$\frac{0.1{2}^{2}}{0.04}$=0.36
若起始时充入N02气体0.080mol,设消耗二氧化氮物质的量浓度为x,2 NO2=N2O4 ,K=$\frac{1}{0.36}$
2 NO2=N2O4
起始量(mol/L) 0.0800 0
变化量(mol/L) x 0.5x
平衡量(mol/L) 0.080-x 0.5x
K=$\frac{0.5x}{(0.080-x)^{2}}$=$\frac{1}{0.36}$
x=0.020mol/L
则达到平衡时N02气体的转化率=$\frac{0.020}{0.080}$×100%=25%,
故答案为:25%.
点评 本题以图象为载体考查化学反应速率、化学平衡的建立、读图提取信息能力,题目难度中等,结合图的信息运用知识解决问题.

| A. | 除去CO2中混有的CO:通入O2点燃 | |
| B. | 除去铜器表面的铜绿【Cu2(OH)2CO3】:用盐酸浸泡,再用清水冲洗 | |
| C. | 除去FeCl3溶液中的FeCl2杂质,加入足量铁粉,再过滤即可 | |
| D. | 欲除去粗盐中的MgCl2、CaCl2和硫酸盐杂质,可加入的药品顺序:NaOH-Na2CO3-BaCl2-盐酸 |
| A. | 铁与稀硫酸反应 2Fe+6H+═2Fe3++3H2↑ | |
| B. | 氢氧化铝与足量盐酸反应 Al(OH)3+3H+═Al3++3H2O | |
| C. | 钠和冷水反应 Na+2H2O═Na++H2↑+OH- | |
| D. | 铜片与稀硝酸反应 Cu+NO3-+4H+═Cu2++NO↑+2H2O |
| A. | 1mol乙醇可以与足量金属钠反应,生成0.5molH2,能证明乙醇分子有一个H原子与其余的H原子不同 | |
| B. | 下列反应可证明苯环受甲基的影响,甲苯易被酸性高锰酸钾氧化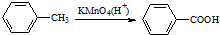 | |
| C. | 下列反应可证明由于羟基对苯环的影响,导致苯酚的取代比苯容易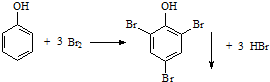 | |
| D. | 苯不能使溴的四氯化碳溶液褪色可以说明苯分子中没有与乙烯分子中类似的碳碳双键 |
| 已知 | 类推 | |
| A | 将Fe加入CuSO4溶液中 Fe+Cu2+═Cu+Fe2+ | 将Na加入到CuSO4溶液中 2Na+Cu2+═Cu+2Na+ |
| B | 向稀硫酸加入NaOH溶液至中性 H++OH-═H2O | 向H2SO4溶液加入Ba(OH)2溶液至中性 H++OH-═H2O |
| C | 向次氯酸钙溶液中通入少量CO2 Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO | 向次氯酸钙溶液中通入少量SO2 Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO |
| D | 向Ca(OH)2溶液中通入过量CO2 CO2+OH-═HCO3- | 向Ca(OH)2溶液中通入过量SO2 SO2+OH-═HSO3- |
| A. | A | B. | B | C. | C | D. | D |
 如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,在c、d两极上共收集到 336mL (标准状态)气体.回答:
如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,在c、d两极上共收集到 336mL (标准状态)气体.回答: 可导致患者出现头痛、恶心等病状,需静脉注射小苏打(NaHCO3)溶液,利用小苏打与水杨酸分子中的羧基反应生成水杨酸钠,使症状缓解.写出水杨酸与小苏打反应的化学方程式:
可导致患者出现头痛、恶心等病状,需静脉注射小苏打(NaHCO3)溶液,利用小苏打与水杨酸分子中的羧基反应生成水杨酸钠,使症状缓解.写出水杨酸与小苏打反应的化学方程式: .
.