题目内容
12.某学习小组设计实验侧定某铝铜合金中铝与铜的物质的量之比.(1)步骤Ⅰ:称量铝铜合金的质量m1,实验室通常使的用的仪器是托盘天平.
(2)步骤Ⅱ:将铝铜合溶于足量的稀盐酸中.观察到的主要现象是有气体生成,金属不能完全溶解.
(3)步骤Ⅲ:过滤、洗涤、干燥,称得滤纸上的剩余固体质量为m2.
(4)已知m1=1.45g,m2=0.64g.计算:该铝铜合金与盐酸反应时释放的氢气在标准状况下的体积.
分析 (1)实验室用托盘天平称量药品;
(2)铝与盐酸反应,而铜不反应;
(4)m2=0.64g,为铜的质量,则铝的质量为1.45g-0.64g=0.81g,结合反应的方程式2Al+6HCl=AlCl3+3H2↑计算.
解答 解:(1)实验室可用托盘天平称量合金的质量,故答案为:托盘天平;
(2)铝与盐酸反应,而铜不反应,可观察到有气泡生成,且剩余金属固体,不能完全溶解,故答案为:有气体生成,金属不能完全溶解;
(4)m2=0.64g,为铜的质量,则铝的质量为1.45g-0.64g=0.81g,且n(Al)=0.03mol,由反应的方程式2Al+6HCl=AlCl3+3H2↑可知n(H2)=0.045mol,
V(H2)=0.045mol×22.4L/mol=1.008L,
答:铝铜合金与盐酸反应时释放的氢气在标准状况下的体积1.008L.
点评 本题考查混合物的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握实验的方法以及计算的思路,难度不大.

练习册系列答案
相关题目
2.下列化学术语或表示方法错误的是( )
| A. | 乙烯的结构简式为:CH2=CH2 | |
| B. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O | |
| C. | 醋酸的分子式:CH3COOH | |
| D. | 乙醇的结构式为: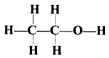 |
3.下列每组物质中化学键类型和分子的极性都相同的是( )
| A. | H2O和CH4 | B. | NaCl和HCl | C. | CO2和CS2 | D. | O2和HBr |
7.将下列物质分别加到湿的红色布条上,不能使其褪色是( )
| A. | 新制氯水 | B. | 液氯 | ||
| C. | 次氯酸钠溶液和HCl混合液 | D. | 氯化钙 |
17.除去MgO中的Al2O3可选用的试剂是( )
| A. | NaOH溶液 | B. | 氨水 | C. | 稀盐酸 | D. | CO气体 |
4.表中括号内物质是杂质,试将除杂试剂及分离方法填入表内:
| 混合物 | SiO2 (Si) | CO2(SO2) | NaHCO3(Na2SiO3) | SiO2(NaCl) |
| 除杂试剂 | 空气 | 饱和碳酸氢钠溶液 | 水、足量二氧化碳 | 水 |
| 除杂方法 | 加热 | 洗气 | 过滤、蒸发 | 过滤 |
1.三种短周期元素X、Y、Z,X最外层只有一个不成对电子,Y的次外层为2个电子,最外层有2对成对电子,Z的全部核外电子有2对成对电子和3个不成对电子,则三种元素所组成的化合物中哪是不可能的?( )
| A. | XZY3 | B. | X3Z | C. | XZY2 | D. | X2ZY |
2.下列物质能使品红溶液褪色,其中是利用强氧化性来漂白的是( )
①活性炭
②过氧化钠
③氯水
④臭氧.
①活性炭
②过氧化钠
③氯水
④臭氧.
| A. | ①③④ | B. | ②③④ | C. | ①②③④ | D. | ①②③④ |