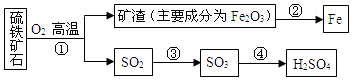
题目内容
4.设NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 常温常压下,22.4L CO2所含的原子数为3NA | |
| B. | 0.5mol C2H2和C6H6的气态混合物中所含原子总数为2NA | |
| C. | 1mol Cl2与足量的Fe完全反应,转移的电子数为2NA | |
| D. | 2L1mol/L的盐酸中所含HCl的分子数约为2NA |
分析 A、常温常压下,气体摩尔体积大于22.4L/mol;
B、混合物中C2H2和C6H6的比例不确定;
C、氯气和铁反应后变为-1价;
D、HCl溶于水后完全电离.
解答 解:A、常温常压下,气体摩尔体积大于22.4L/mol,故22.4L二氧化碳的物质的量小于1mol,则含有的原子个数小于3NA个,故A错误;
B、混合物中C2H2和C6H6的比例不确定,故0.5mol混合物中含有的原子个数无法计算,故B错误;
C、氯气和铁反应后变为-1价,故1mol氯气转移的电子数为2NA个,故C正确;
D、HCl溶于水后完全电离,故盐酸溶液中无HCl分子,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
10.下列对实验室突发事件的处理,合理的是( )
| A. | 日光灯管破碎,只需收集散落的汞即可 | |
| B. | 金属镁失火,应采用泡沫灭火器灭火 | |
| C. | 钡离子中毒,可以通过服用碳酸钠溶液解毒 | |
| D. | 烧碱溶液溅到皮肤上,应立即用大量的水冲洗 |
11.实验现象描述错误的是( )
| A. | 碘单质受热升华:紫色蒸气 | B. | 硫磺在氧气中燃烧:蓝紫色的火焰 | ||
| C. | 铁丝在氯气中燃烧:棕褐色的烟 | D. | 氢气在氯气中燃烧:淡蓝色火焰 |
9.下列各组物质的溶液中,不需要外加试剂就能鉴别的一组是( )
| A. | FeCl3、Fe2(SO4)3、Fe(NO3)3、FeBr3 | B. | FeCl3、Na2CO3、NaOH、NaCl | ||
| C. | FeSO4、MgSO4、Na2SO4、H2O2 | D. | FeCl2、NH4Cl、MgCl2、KCl |
16.A、B两元素形成离子化合物时,一个A原子要失去1个电子转移给B原子,而一个B原子要得到2个A原子的电子.下列有关说法正确的是( )
| A. | 它们形成的离子化合物化学式为AB2 | |
| B. | 原子序数:A一定大于B | |
| C. | A和B形成的离子电子层结构一定相同 | |
| D. | A一定是金属,B一定是非金属 |
13.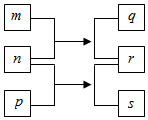 W、X、Y、Z是原子序数依次增大的短周期元素.m、n、p是由这些元素组成的二元化合物,r是元素Y的常见单质,能使带火星的木条复燃,q的水溶液呈碱性,0.01mol•L-1s溶液的pH为12,q、s的焰色反应均呈黄色.上述物质的转化关系如图所示.下列说法正确的是( )
W、X、Y、Z是原子序数依次增大的短周期元素.m、n、p是由这些元素组成的二元化合物,r是元素Y的常见单质,能使带火星的木条复燃,q的水溶液呈碱性,0.01mol•L-1s溶液的pH为12,q、s的焰色反应均呈黄色.上述物质的转化关系如图所示.下列说法正确的是( )
 W、X、Y、Z是原子序数依次增大的短周期元素.m、n、p是由这些元素组成的二元化合物,r是元素Y的常见单质,能使带火星的木条复燃,q的水溶液呈碱性,0.01mol•L-1s溶液的pH为12,q、s的焰色反应均呈黄色.上述物质的转化关系如图所示.下列说法正确的是( )
W、X、Y、Z是原子序数依次增大的短周期元素.m、n、p是由这些元素组成的二元化合物,r是元素Y的常见单质,能使带火星的木条复燃,q的水溶液呈碱性,0.01mol•L-1s溶液的pH为12,q、s的焰色反应均呈黄色.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 原子半径:W<X<Y<Z | |
| B. | Y的氢化物的沸点比Z的氢化物的沸点高 | |
| C. | 通常状况下,X的氢化物可能呈气态、液态或固态 | |
| D. | 由W、X、Y、Z四种元素只能组成一种化合物 |