题目内容
14.工业上用硫铁矿石(主要成分FeS2)在沸腾炉中焙烧,经过一系列反应,得到硫酸,焙烧后的矿渣用于炼铁.其转化过程如图所示(部分条件、反应物和产物已略去):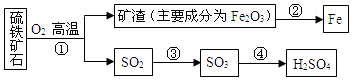
请回答下列问题:
(1)在上面转化过程中,硫元素被氧化的反应是①③(填反应编号).
(2)写出反应②中炼铁的化学方程式3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$ 2Fe+3CO2.若用1000t含杂质28%的矿渣炼铁,理论上可得到含铁96%的生铁质量为525 t.
(3)写出反应①的化学方程式4FeS2+11O2 $\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,若有12.0g FeS2参加反应,则发生转移的电子数为6.62×1023.
(4)烟气中SO2的排放会造成酸雨,工业上常用Na2SO3溶液来吸收SO2以减少对环境的危害.
①常温下,将SO2通入一定体积的1.0mol•L-1Na2SO3溶液中,溶液pH不断减小.当溶液pH约为6时,吸收SO2的能力显著下降,此时溶液中c(SO32-)的浓度是0.2mol•L-1,则溶液中c(HSO3-)是1.6mol•L-1.用化学平衡原理解释此时溶液显酸性的原因HSO3-?H++SO32-和HSO3-+H2O?H2SO3+OH-,HSO3-的电离程度大于其水解程度.
②向①中pH约为6时的吸收液中通入足量O2充分反应.取反应后溶液10mL与10mLBaCl2溶液混合,欲使混合时能生成沉淀,所用BaCl2溶液的浓度不得低于2.4×10-10mol•L-1.[已知25℃时,Ksp(BaSO3)=5.48×10-7,Ksp(BaSO4)=1.08×10-10].
分析 硫铁矿石(主要成分FeS2)在沸腾炉中焙烧,得到二氧化硫和矿渣主要成分为氧化铁,二氧化硫催化氧化生成三氧化硫,三氧化硫溶于水生成硫酸,氧化铁被一氧化碳还原生成单质铁,
(1)被氧化的元素是在反应中化合价升高;
(2)反应②中炼铁的反应为一氧化碳还原氧化铜铁生成铁和一氧化碳,结合化学方程式定量关系计算;
(3)反应①是硫铁矿石中硫化亚铁被氧气氧化生成氧化铁和二氧化硫,化学方程式中定量关系和盐酸化合价变化计算电子转移总数来计算有12.0g FeS2参加反应,则发生转移的电子数;
(4)①结合2Na2SO3+SO2+H2O═2NaHSO3分析离子浓度,溶液pH约为6时,吸收SO2的能力显著下降,溶质为NaHSO3,则电离大于其水解.
②向pH约为6的吸收剂中通入足量的O2,发生氧化还原反应生成硫酸钠和硫酸,结合硫元素守恒计算,注意溶液体积变化.
解答 解:(1)在上面转化过程中,硫元素被氧化的反应是①4FeS2+11O2 $\frac{\underline{\;高温\;}}{\;}$ 2Fe2O3+8SO2,反应中硫元素化合价-1价变化为+4价升高被氧化,③反应为2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3,反应中硫元素化合价+4价变化为+6价被氧化,
故答案为:①③;
(2)反应②中炼铁的反应为一氧化碳还原氧化铜铁生成铁和一氧化碳,反应的化学方程式为:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$ 2Fe+3CO2,若用1000t含杂质28%的矿渣炼铁,理论上可得到含铁96%的生铁质量为x,
3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$ 2Fe+3CO2,
160 112
1000t×(1-28%) 96%x
x=525
故答案为:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$ 2Fe+3CO2; 525;
(3)反应①是硫铁矿石中硫化亚铁被氧气氧化生成氧化铁和二氧化硫,反应的化学方程式为:4FeS2+11O2 $\frac{\underline{\;高温\;}}{\;}$ 2Fe2O3+8SO2,反应中电子转移总数44e-,反应的FeS2的质量为480g,则若有12.0g FeS2参加反应,则发生转移的电子数为1.1mol,电子转移总数6.62×1023或1.1NA,
故答案为:4FeS2+11O2 $\frac{\underline{\;高温\;}}{\;}$ 2Fe2O3+8SO2; 6.62×1023或1.1NA;
(4)①由2Na2SO3+SO2+H2O═2NaHSO3,c(SO32-)的浓度是0.2mol•L-1,则反应的Na2SO3溶液为1.0mol/L-0.2mol/L=0.8mol/L,由反应中的物质的量关系可知,生成的c(HSO3-)为0.8mol/L×2=1.6mol/L;溶液中c(HSO3-)则电离大于其水解,溶液显酸性,涉及平衡有HSO3-?H++SO32-和HSO3-+H2O?H2SO3+OH-,HSO3-的电离程度大于其水解程度,
故答案为:1.6;HSO3-?H++SO32-和HSO3-+H2O?H2SO3+OH-,HSO3-的电离程度大于其水解程度;
②向pH约为6的吸收剂中通入足量的O2,发生氧化还原反应生成硫酸钠和硫酸,发生的反应为2NaHSO3+O2═Na2SO4+H2SO4,2Na2SO3+O2=2Na2SO4,则硫元素守恒得到混合溶液中硫酸根离子浓度=$\frac{0.01L×0.2mol/L+0.01L×1.6mol/L}{0.02L}$=0.9mol/L,
c(Ba2+)=$\frac{1.08×1{0}^{-10}}{0.9mol/L}$=1.2×10-10mol/L,则所用BaCl2溶液的浓度不得低于2.4×10-10mol/L,
故答案为:2.4×10-10.
点评 本题考查了物质分离提纯、化学方程式计算、盐类水解应用、氧化还原反应的电子转移等知识点,掌握基础是解题关键,题目难度中等.

| A. | 常温常压下,22.4L CO2所含的原子数为3NA | |
| B. | 0.5mol C2H2和C6H6的气态混合物中所含原子总数为2NA | |
| C. | 1mol Cl2与足量的Fe完全反应,转移的电子数为2NA | |
| D. | 2L1mol/L的盐酸中所含HCl的分子数约为2NA |
| A. | 铵态氮肥不能与草木灰混合使用 | |
| B. | 大力推进小火力发电站的兴建,以缓解地方用电困难 | |
| C. | 医学上,常使用BaSO4做内服造影剂 | |
| D. | 为防止电池中重金属等污染环境和水体,应积极开发废旧电池的综合技术 |
| A. | Fe2+、H+、SO42-、MnO4- | B. | Al3+、Na+、Cl-、AlO2- | ||
| C. | Ba2+、Na+、HCO3-、Cl- | D. | Fe3+、Mg2+、SCN-、Cl- |
| A. | 氮的固定是指气态氮变为固态 | |
| B. | “歼-20”飞机上使用的碳纤维是一种新型的有机高分子材料 | |
| C. | 利用二氧化碳制造全降解塑料,可以缓解温室效应 | |
| D. | 石油分馏、煤的干馏、蛋白质的变性和纳米银粒子的聚集都是化学变化 |
| A. | 钠保存在煤油中 | |
| B. | 保存碱性溶液的试剂瓶的瓶塞要用橡胶塞 | |
| C. | 硝酸保存到棕色的试剂瓶中,并放置在冷暗处 | |
| D. | 氢氟酸保存到玻璃试剂瓶中 |
| A. | 加入适量水 | B. | 加入少量盐酸 | C. | 加入适量KOH固体 | D. | 加热 |
| A. | NaHCO3=Na++H++CO32- | B. | Cu(OH)2?Cu2++2OH- | ||
| C. | CH3COONH4=CH3COO-+NH4+ | D. | H2S?H++HS- |