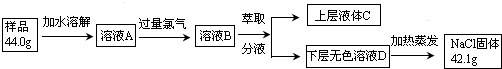
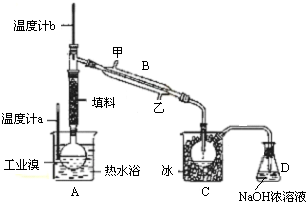
题目内容
4.NA表示阿伏加德罗常数,下列叙述正确的是( )| A. | 0oC,1.01×106Pa时,11.2L氧气所含的氧原子数为NA | |
| B. | 标准状况下,80gSO3所占的体积约为22.4L | |
| C. | 31g白磷分子中,含有的共价单键数目是NA | |
| D. | 0.5 mol Na2O2中含有的阴离子数为0.5NA |
分析 A.0oC,1.01×106Pa,不是标准状况;
B.标况下,三氧化硫不是气体;
C.每个白磷分子含有4个P原子,每个白磷分子中P-P键数目为6;
D.过氧化钠中阴离子为过氧根离子.
解答 解:A.0oC,1.01×106Pa,不是标准状况,Vm≠22.4L/mol,无法计算氧气的物质的量,故A错误;
B.标况下,三氧化硫不是气体,不能使用气体摩尔体积,故B错误;
C.31g白磷分子的物质的量为$\frac{31g}{124g/mol}$=0.25mol,存在的共价键数目=0.25mol×6×NA/mol=1.5NA,故C错误;
D.5 mol Na2O2中含有的阴离子数为0.5NA,故D正确;
故选:D.
点评 本题考查阿伏伽德罗常数的应用及相关计算,明确气体摩尔体积使用对象,白磷分子的结构、过氧化钠的结构是解题关键,题目难度不大.

练习册系列答案
相关题目
14.以下物质间的每步转化通过一步反应能实现的是( )
| A. | Fe-FeCl2-FeCl3-Fe(OH)3 | B. | Al-Al2O3-Al(OH)3-NaAlO2 | ||
| C. | S-SO3-H2SO4-MgSO4 | D. | N2-NO2-NO-HNO3 |
15.实验室需配制一种只含有四种离子(除H+和OH-外)的混合溶液,且在该混合溶液中四种离子的物质的量浓度均为0.1mol/L,以下各组能达到此目的是( )
| A. | K+、SO42-、I-、NO3- | B. | Cu2+、Na+、Cl-、S2- | ||
| C. | Ca2+、K+、HCO3-、NO3- | D. | K+、Na+、CH3COO-、Br- |
19.一定温度下,测定某溶液中只含NH4+、Cl-、H+、OH-四种离子,下列说法一定正确的是( )
| A. | 溶液中四种粒子之间满足:c(Cl-)>c(H+)>c(NH4+)>c(OH-) | |
| B. | 若溶液中粒子间满足:c(NH4+)>c(Cl-)>c(OH-)>c(H+),则溶液中溶质为:NH3•H2O和NH4Cl | |
| C. | 若溶液中粒子间满足:c(Cl-)>c(NH4+)>c(H+)>c(OH-),则溶液中溶质只有NH4Cl | |
| D. | 若溶液中c(NH4+)=c(Cl-),则该溶液pH等于7. |
9.下列有关实验操作及安全知识的叙述,正确的是( )
| A. | 实验室做钠的实验时,余下的钠屑投入到废液缸中 | |
| B. | 实验室制硝基苯时,将硝酸与苯混合后再滴加浓硫酸 | |
| C. | 把玻璃管插入橡胶塞孔时,可用厚布护手,紧握用水湿润的玻管,缓慢旋进塞孔中 | |
| D. | 实验室制乙酸丁酯时,须用水浴加热 |
13.下列有关电解质溶液的说法正确的是( )
| A. | KCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 | |
| B. | 向氟化钠溶液中加入适量氢氟酸,得到的酸性混合溶液:c(Na+)>c(F-)>c(H+)>c(OH-) | |
| C. | 25℃时,等体积pH=3的HA和HB两种酸分别与足量的锌反应,相同时间内HA与Zn反应生成的氢气更多,HA是弱酸 | |
| D. | Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小 |
14.下列有机反应中,哪一个反应与其它三个反应的反应类型不同的是( )
| A. | CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O | |
| B. | 2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O | |
| C. | CH3CH2Br+NaOH$\stackrel{H_{2}O}{→}$CH3CH2OH+NaBr | |
| D. | 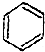 +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$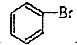 +HBr +HBr |