题目内容
已知下列反应的反应热为:
(1)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H1=-870.3KJ/mol
(2)C(s)+O2(g)=CO2(g)△H2=-393.5KJ/mol
(3)H2(g)+
O2(g)=H2O(l)△H3=-285.8KJ/mol
试计算下列反应的焓变:2C(s)+2H2(g)+O2(g)=CH3COOH(l)△H( )
(1)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H1=-870.3KJ/mol
(2)C(s)+O2(g)=CO2(g)△H2=-393.5KJ/mol
(3)H2(g)+
| 1 |
| 2 |
试计算下列反应的焓变:2C(s)+2H2(g)+O2(g)=CH3COOH(l)△H( )
| A、-488.3 KJ/mol |
| B、+488.3KJ/mol |
| C、-245.7KJ/mol |
| D、+245.7KJ/mol |
考点:有关反应热的计算
专题:化学反应中的能量变化
分析:由盖斯定律可知2×(2)+(3)-(1)得:2C(s)+2H2(g)+O2(g)=CH3COOH(l),则△H=2△H2+△H3-△H1,带入数据进行计算.
解答:
解:已知(1)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H1=-870.3KJ/mol
(2)C(s)+O2(g)=CO2(g)△H2=-393.5KJ/mol
(3)2H2(g)+O2(g)=2H2O(l)△H3=-571.6KJ/mol
将方程式2×(2)+(3)-(1)得:2C(s)+2H2(g)+O2(g)=CH3COOH(l),
则△H=2△H2+△H3-△H1=2(-393.5kJ/mol)+(-571.6KJ/mol)-(-870.3KJ/mol)=-488.3kJ/mol,
故选A.
(2)C(s)+O2(g)=CO2(g)△H2=-393.5KJ/mol
(3)2H2(g)+O2(g)=2H2O(l)△H3=-571.6KJ/mol
将方程式2×(2)+(3)-(1)得:2C(s)+2H2(g)+O2(g)=CH3COOH(l),
则△H=2△H2+△H3-△H1=2(-393.5kJ/mol)+(-571.6KJ/mol)-(-870.3KJ/mol)=-488.3kJ/mol,
故选A.
点评:本题考查化学反应与能量,侧重于盖斯定律的运用,注意把握盖斯定律的原理以及计算方法,难度不大.

练习册系列答案
 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目
两种金属的混合粉末25g,与足量盐酸充分反应后,得到标准状况下的氢气11.2L.下列各组金属不可能的是( )
| A、Mg和Zn |
| B、Mg和Fe |
| C、A1和Na |
| D、A1和Cu |
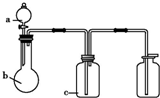 图中a、b、c表示相应仪器中加入的试剂,可用下图装置制取、净化、收集的
图中a、b、c表示相应仪器中加入的试剂,可用下图装置制取、净化、收集的气体是( )
| 编号 | 气体 | a | b | c |
| A | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
| B | CO2 | 盐酸 | 碳酸钙 | 饱和NaHCO3溶液 |
| C | NO | 稀HNO3 | 铜屑 | H2O |
| D | Cl2 | 浓盐酸 | 高锰酸钾 | NaOH溶液 |
| A、A | B、B | C、C | D、D |
为了证明(NH4)2Fe(SO4)2?6H2O(硫酸亚铁铵晶体)的成分中含有NH4+、Fe2+、SO42-和H2O,取少量硫酸亚铁铵晶体放入试管,下列实验叙述中错误的是( )
| A、加热,试管口有液体生成,则可证明晶体的成分中含有结晶水 |
| B、加少量水,溶液为浅绿色,滴入2滴KSCN溶液,溶液不显红色,再滴加几滴新制氯水,溶液变为红色,则证明晶体的成分中含有Fe2+ |
| C、加水溶解,加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO42- |
| D、加浓NaOH溶液,加热,用湿润的蓝色石蕊试纸放在试管口检验,试纸变红色,则证明晶体的成分中含有NH4+ |
下列过程中,需要加快化学反应速率的是( )
| A、钢铁的腐蚀 | B、食物腐烂 |
| C、工业炼钢 | D、塑料老化 |
下列溶液显碱性的是( )
| A、AlCl3 |
| B、KHCO3 |
| C、Fe2(SO4)3 |
| D、NH4Cl |