题目内容
1.过氧化钙(CaO2)常用作种子及谷物的无毒性消毒剂,常温下为白色的固体,微溶于水,且不溶于乙醇、乙醚或碱性溶液,但溶于酸.某实验小组拟探究CaO2的性质及其实验室制法.(1)实验探究CaO2与酸的反应.
| 操作 | 现象 |
| 向盛有4g CaO2的大试管中加入10mL稀盐酸的溶液a | 剧烈反应,产生能使带火星木条复燃的气体 |
| 取5mL溶液a于试管中,滴入两滴石蕊 | 溶液变红,一段时间后溶液颜色明显变浅,稍后,溶液变为无色 |
②加入石蕊后溶液褪色可能是因为溶液a中存在较多的H2O2.
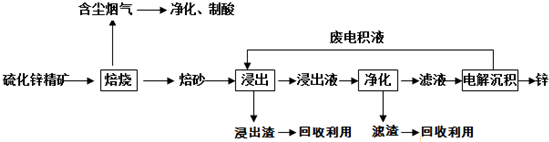
(2)用如图1所示装置制备过氧化钙,其反应原理为Ca+O2$\frac{\underline{\;\;△\;\;}}{\;}$ CaO2
①请选择实验所需的装置,案气流方向连接的顺序为d→e→f→b→c(或d→e→f→c→b)(填仪器接口的字母,上述装置可不选用也可重复使用).
②根据完整的实验装置进行实验,实验步骤如下:Ⅰ.检验装置的气密性后,装入药品;Ⅱ.打开分液漏斗活塞,通入气体一段时间,加热药品;Ⅲ反应结束后,熄灭酒精灯,待反应管冷却至室温,停止通入氧气,并关闭分液漏斗的活塞(填操作); IV拆除装置,取出产物.
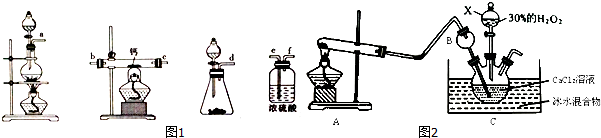
(3)利用反应Ca2++H2O2+8H2O=CaO2•8H2O↓+2NH4+在碱性环境下制取CaO2的装置如图2所示.
①NH3在Ca2+和 H2O2的反应过程中所起的作用是中和生成的氢离子,促进反应进行.
②反应结束后,经过滤、洗涤、低温烘干可获得CaO2•8H2O,过滤所需要的玻璃仪器是烧杯、漏斗、玻璃棒;将沉淀进行洗涤的操作为沿玻璃棒向漏斗中注入蒸馏水至浸没沉淀,让水自然流下,重复2-3次.
(4)设计实验证明CaO2的氧化性比FeCl3的氧化性强:在FeCl2溶液中滴加KSCN溶液,溶液不显红色,再加入少量CaO2粉末,溶液变红色,说明CaO2的氧化性比FeCl3的氧化性强.
分析 (1)①产生能使带火星木条复燃的气体为氧气,反应还生成氯化钙与水;
②反应过程中会生成过氧化氢,可以使溶液红色褪去;
(2)①锥形瓶内利用二氧化锰作催化剂分解过氧化氢生成氧气,用浓硫酸干燥,然后氧气与钙反应生成CaO2;
②实验结束,熄灭酒精灯,待反应管冷却至室温,停止通入氧气,并关闭分液漏斗的活塞;
(3)①由反应可知,钙离子结合过氧根离子,会生成氢离子,氨气中和生成的氢离子;
②过滤所需要的玻璃仪器是:烧杯、漏斗、玻璃棒;洗涤沉淀方法为:沿玻璃棒向漏斗中注入蒸馏水至浸没沉淀,让水自然流下,重复2-3次;
(4)在FeCl2溶液中滴加KSCN溶液,溶液不显红色,再加入少量CaO2粉末,溶液变红色.
解答 解:(1)①产生能使带火星木条复燃的气体为氧气,反应还生成氯化钙与水,反应方程式为:2CaO2+4HCl=2CaCl2+2H2O+O2↑,
故答案为:2CaO2+4HCl=2CaCl2+2H2O+O2↑;
②加入石蕊后溶液褪色可能是因为溶液a中存在较多的H2O2,具有强氧化性,使溶液红色褪去;
故答案为:H2O2;
(2)①锥形瓶内利用二氧化锰作催化剂分解过氧化氢生成氧气,用浓硫酸干燥,然后氧气与钙反应生成CaO2,气流方向连接的顺序为:d→e→f→b→c(或d→e→f→c→b)
故答案为:d→e→f→b→c(或d→e→f→c→b);
②实验结束,熄灭酒精灯,待反应管冷却至室温,停止通入氧气,并关闭分液漏斗的活塞,
故答案为:熄灭酒精灯,待反应管冷却至室温,停止通入氧气,并关闭分液漏斗的活塞;
(3)①由反应可知,钙离子结合过氧根离子,会生成氢离子,中和生成的氢离子,促进反应进行,
故答案为:中和生成的氢离子,促进反应进行;
②过滤所需要的玻璃仪器是:烧杯、漏斗、玻璃棒;洗涤沉淀方法为:沿玻璃棒向漏斗中注入蒸馏水至浸没沉淀,让水自然流下,重复2-3次,
故答案为:烧杯、漏斗、玻璃棒;沿玻璃棒向漏斗中注入蒸馏水至浸没沉淀,让水自然流下,重复2-3次;
(4)在FeCl2溶液中滴加KSCN溶液,溶液不显红色,再加入少量CaO2粉末,溶液变红色,说明CaO2的氧化性比FeCl3的氧化性强,
故答案为:在FeCl2溶液中滴加KSCN溶液,溶液不显红色,再加入少量CaO2粉末,溶液变红色,说明CaO2的氧化性比FeCl3的氧化性强.
点评 本题考查物质性质探究实验、制备实验、物质的分离提纯、实验方案设计等,注意对实验基本操作的掌握.

 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案| A. | 10min内,Y的平均反应速率为0.03 mol•Lˉ1•sˉ1 | |
| B. | 第10min时,X的反应速率为0.01 mol•Lˉ1•minˉ1 | |
| C. | 10min内,消耗0.2 mol X,生成0.4 mol Z | |
| D. | 10min内,X和Y反应放出的热量为a kJ |
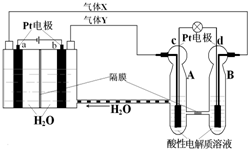 RFC是一种将水电解技术与氢氧燃料电池技术相互结合的可充电电池,RFC工作原理如图所示.则下列有关说法正确的是( )
RFC是一种将水电解技术与氢氧燃料电池技术相互结合的可充电电池,RFC工作原理如图所示.则下列有关说法正确的是( )| A. | c电极发生还原反应,B池中H+通过隔膜进入A池 | |
| B. | b电极上发生的电极反应是:2H2O+2e-═H2↑+2OH- | |
| C. | 转移0.1mol电子时,a电极产生标准状况O21.12L | |
| D. | d电极上发生的电极反应是:O2+4H++4e-═2H2O |
| A. | 当a=0.1时,发生的反应为2I-+Br2═I2+2Br- | |
| B. | 当a=0.25时,发生的反应为2Fe2++4I-+3Br2═2Fe3++2I2+6Br- | |
| C. | 当溶液中I-有一半被氧化时,c(I-):c(Br-)=1:1 | |
| D. | 当0.2<a<0.3时,溶液中各离子浓度的关系为2c(Fe2+)+3c(Fe3+)+c(H+)═c(Br-)+c(OH-) |
| A. | X与Y形成的两种化合物中阴阳离子个数比为1:2 | |
| B. | Y分别与Z、W、R以两种元素组成的常见化合物有5种 | |
| C. | Y的氢化物比R的氢化物稳定,Y的氢化物熔沸点比R的氢化物熔沸点低 | |
| D. | Z、W、R的最高价氧化物对应水化物的酸性强弱顺序是R>W>Z |
| A. | 若溶液pH=7,则c(A-)=c(HA) | |
| B. | 若c(A-)>c(HA),则溶液中水电离的c(H+)<1.0×10-7mol/L | |
| C. | 若pH>7,加水稀释c(A-)/c(HA)增大 | |
| D. | 溶液中,c(A-)=2c(H+)+c(HA)-2c(OH-) |
 亚氯酸钠(NaClO2)是重要漂白剂.探究小组开展如下实验,回答下列问题:
亚氯酸钠(NaClO2)是重要漂白剂.探究小组开展如下实验,回答下列问题: 某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.
某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.