题目内容
3.(1)工业上可以利用反应I所示原理降低污染气体的排放,并回收燃煤痼气中的硫.已知:反应I:2CO(g)+SO2(g)?2CO2(g)+S(l)△H1
反应Ⅱ:2CO2(g)?2CO(g)+O2(g)△H2=+566.0kJ•mol-1
反应Ⅲ:S(l)+O2(g)?SO2(g)△H3=-296.0kJ•mol-1
则△H1=-270kJ?mol-1.
(2)把0.6mol X气体和0.4mol Y气体混合于2L容器中,发生反应3X(g)+Y(g)?nZ(g)+2W(g),5min末生成0.2mol W,若测知以Z的浓度变化来表示平均速率为0.01mol/(L•min),则上述反应中Z气体的计量系数n=1.
(3)CO和H2可以通过反应C(s)+H2O(g)?CO(g)+H2 (g) 制取.在恒温恒容下,若从反应物出发建立平衡,能说明该反应已达到平衡的是AC.
A.体系压强不再变化
B.CO与H2的物质的量之比为1:1
C.混合气体的密度保持不变
D.每消耗1mol H2O(g)的同时生成1mol H2
(4)氯化铵的水溶液显弱酸性,其原因为NH4++H2O?NH3•H2O+H+(用离子方程式表示),若加入少量的明矾,溶液中的NH4+的浓度增大(填“增大”或“减小”或“不变”).
(5)为更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$,常温下0.1 mol•L-1盐酸溶液的AG=12.
(6)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:CaSO4(s)+CO${\;}_{3}^{2-}$?CaCO3(s)+SO${\;}_{4}^{2-}$
已知298K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,
求此温度下该反应的平衡常数K=1.75×104.(计算结果保留三位有效数字).
分析 (1)反应Ⅱ:2CO2(g)?2CO(g)+O2(g)△H2=+566.0kJ•mol-1
反应Ⅲ:S(l)+O2(g)?SO2(g)△H3=-296.0kJ•mol-1
由盖斯定律可知,-Ⅱ-Ⅲ得到反应I:2CO(g)+SO2(g)?2CO2(g)+S(l);
(2)5min末生成0.2mol W,v(W)=$\frac{\frac{0.2mol}{2L}}{5min}$=0.01mol/(L•min),若测知以Z的浓度变化来表示平均速率为0.01mol/(L•min),速率之比等于化学计量数之比;
(3)结合平衡的特征“等、定”判定平衡状态;
(4)铵根离子水解显酸性,明矾溶于水后铝离子水解显酸性,抑制铵根离子水解;
(5)常温下0.1 mol•L-1盐酸溶液的AG=lg$\frac{0.1}{1{0}^{-13}}$;
(6)此温度下该反应的平衡常数K=$\frac{c(S{O}_{4}{\;}^{2-})}{c(C{{O}_{3}}^{2-})}$=$\frac{Ksp(CaS{O}_{4})}{Ksp(CaC{O}_{3})}$.
解答 解:(1)反应Ⅱ:2CO2(g)?2CO(g)+O2(g)△H2=+566.0kJ•mol-1
反应Ⅲ:S(l)+O2(g)?SO2(g)△H3=-296.0kJ•mol-1
由盖斯定律可知,-Ⅱ-Ⅲ得到反应I:2CO(g)+SO2(g)?2CO2(g)+S(l),△H1=-(+566.0kJ•mol-1)-(-296.0kJ•mol-1)=-270kJ?mol-1,
故答案为:-270kJ?mol-1;
(2)5min末生成0.2mol W,v(W)=$\frac{\frac{0.2mol}{2L}}{5min}$=0.01mol/(L•min),若测知以Z的浓度变化来表示平均速率为0.01mol/(L•min),速率之比等于化学计量数之比,W、Z的速率相同,则n=1,
故答案为:1;
(3)A.C为固体,气体的物质的量为变量,则体系压强不再变化,为平衡状态,故A选;
B.CO与H2的物质的量之比为1:1,不能判定平衡,故B不选;
C.C为固体,气体的质量为变量,混合气体的密度保持不变,为平衡状态,故C选;
D.每消耗1mol H2O(g)的同时生成1mol H2,只体现正反应速率,不能判断平衡状态,故D不选;
故答案为:AC;
(4)氯化铵的水溶液显弱酸性,其原因为NH4++H2O?NH3•H2O+H+,明矾溶于水后铝离子水解显酸性,抑制铵根离子水解,溶液中的NH4+的浓度增大,
故答案为:NH4++H2O?NH3•H2O+H+;增大;
(5)常温下0.1 mol•L-1盐酸溶液中,c(H+)=0.1mol/L,c(OH-)=$\frac{Kw}{0.1}$,AG=lg$\frac{0.1}{1{0}^{-13}}$=12,故答案为:12;
(6)此温度下该反应的平衡常数K=$\frac{c(S{O}_{4}{\;}^{2-})}{c(C{{O}_{3}}^{2-})}$=$\frac{Ksp(CaS{O}_{4})}{Ksp(CaC{O}_{3})}$=$\frac{4.90×1{0}^{-5}}{2.80×1{0}^{-9}}$=1.75×104,故答案为:1.75×104.
点评 本题考查较综合,涉及盖斯定律应用、速率计算、K计算及平衡判定、盐类水解等,为高频考点,把握化学反应原理为解答的关键,侧重分析与计算能力的考查,综合性较强,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 根据物质能否导电,可以将化合物分为电解质和非电解质 | |
| B. | 根据氧化物中是否含有金属元素,可以将氧化物分为碱性氧化物和酸性氧化物 | |
| C. | 根据组成元素的种类,将纯净物分为单质和化合物 | |
| D. | 根据分散系的稳定性大小,可以将分散系分为胶体、浊液和溶液 |
(1)按物质的树状分类法填写表格的空白处:
| 分类标准 | 金属单质 | 氧化物 | 溶液 | 胶体 |
| 属于该类的物质 | ② | ⑧⑨ |
2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(g)
(1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图1所示.A点的正反应速率v正(CO2)>B点的逆反应速率v逆(CO2)(填“>”、“<”或“=”);
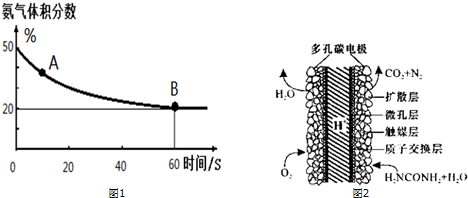
氨气的平衡转化率为75%.
(2)氨基甲酸铵是合成尿素的一种中间产物.将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡:
2NH3(g)+CO2(g)═NH2COONH4(s)
将实验测得的不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A.△H<0,△S<0 B.△H>0,△S<0
C.△H>0,△S>0 D.△H<0,△S>0
②关于上述反应的平衡状态下列说法正确的是C
A.分离出少量的氨基甲酸铵,反应物的转化率将增大
B.平衡时降低体系温度,CO2的体积分数下降
C.NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高氨基甲酸铵的产率
③氨基甲酸铵极易水解成碳酸铵,酸性条件水解更彻底.将氨基甲酸铵粉末逐渐加入1L0.1mol/L的盐酸溶液中直到pH=7(室温下,忽略溶液体积变化),共用去0.052mol氨基甲酸铵,此时溶液中几乎不含碳元素.
此时溶液中c(NH4+)=0.1mol/L;(填具体数值)
NH4+水解平衡常数值为4×10-9.
(3)化学家正在研究尿素动力燃料电池,尿液也能发电!用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电.尿素燃料电池结构如图2所示,写出该电池的负极反应式:CO(NH2)2+H2O-6e-═N2↑+CO2↑+6H+.
(1).用活性炭还原法可以处理汽车尾气中的氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g)?N2(g)+CO2(g)△H,在T1℃时,反应进行到不同时间测得各物质的量浓度如表:
| 时间/min 浓度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 2.0 | 1.16 | 0.80 | 0.80 | 0.96 | 0.96 |
| N2 | 0 | 0.42 | 0.60 | 0.60 | 0.72 | 0.72 |
| CO2 | 0 | 0.42 | 0.60 | 0.60 | 0.72 | 0.72 |
v(N2)=0.03mol•L-1•min-1;计算该反应的平衡常数K=0.5625.
②30min后,只改变某一条件,根据上表的数据判断改变的条件可能是BC(填字母代号).
A.加入合适的催化剂 B.适当缩小容器的体积
C.通入一定量的NO D.加入一定量的活性炭
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则达到新平衡时NO的转化率降低(填“升高”或“降低”),△H<0(填“>”或“<”).
(2)工业上用CO2和H2反应合成二甲醚.已知:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-49.1kJ•mol-1
2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-24.5kJ•mol-1
写出CO2(g)和H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H=-122.7kJ•mol-1.
(3)二甲醚燃料电池具有能量转化率高、电量大的特点而被广泛应用,一种二甲醚氧气电池(电解质为KOH溶液)的负极反应式为:CH3OCH3-12e-+16OH-═2CO32-+11H2O.

| A. | 萃取操作时,振荡过程中需要放气,放气是通过打开分液漏斗上口的玻璃塞进行的 | |
| B. | 加热胆矾晶体使其失去结晶水,用图3装置 | |
| C. | 分离CCl4和I2的混合液,如图1和图2操作 | |
| D. | 蒸馏海水得到淡水,用图4装置 |
| A. | 硝酸银溶液跟铜反应 Cu+Ag+═Cu2++Ag | |
| B. | 铁粉跟稀盐酸反应 2Fe+6H+═2Fe3++3H2↑ | |
| C. | 硫酸和氢氧化钡反应:H++SO42-+Ba2++OH-═H2O+BaSO4 | |
| D. | 用小苏打治疗胃酸过多:HCO3-+H+═CO2↑+H2O |