题目内容
9.(1)容量瓶的构造一定包含一段细的“长颈”,理由是颈部较细,是为了配置的溶液浓度更准确,长颈方便定容,能保证准确的容积,且视觉误差小(2)有些盐既不溶于水也难溶于酸,例如硫酸盐中的硫酸钡和卤化物中的氯化银.
(3)容量瓶上未必标有溶液浓度.
分析 (1)颈部较细,是为了配置的溶液浓度更准确;
(2)硫酸钡和氯化银既不溶于水也难溶于酸;
(3)容量瓶上标有:温度、规格、刻度线.
解答 解:(1)容量瓶是专门用来准确配置一定浓度的溶液的容器,具有长颈,而且颈部较细,是为了配置的溶液浓度更准确,长颈方便定容,能保证准确的容积,且视觉误差小,故答案为:颈部较细,是为了配置的溶液浓度更准确,长颈方便定容,能保证准确的容积,且视觉误差小;
(2)硫酸盐中的硫酸钡和卤化物中的氯化银既不溶于水也难溶于酸,故答案为:;硫酸钡;氯化银;
(3)容量瓶上标有:温度、规格、刻度线,不标溶液浓度,故答案为:溶液浓度.
点评 本题考查化学实验的基本操作,题目难度不大,熟悉各种仪器的用途及使用注意事项、掌握常见化学实验基本操作的注意事项是解答此类试题的关键.

练习册系列答案
相关题目
19.下列说法正确的是( )
| A. | 1gH2和4gO2反应放出71.45kJ热量,则氢气的燃烧热为142.9 kJ•mol-1 | |
| B. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(1)△H=-57.3 kJ•mol-1,若将含0.5molH2SO4的浓硫酸与含1molNaOH的氢氧化钠溶液混合,放出的热量大于57.3kJ | |
| C. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1 | |
| D. | 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷燃烧热 |
20.某有机物有如下性质:①能和银氨溶液共热得到银镜;②加入碳酸氢钠无变化;③与含酚酞的氢氧化钠溶液共热,发现红色褪去.则该有机物可能是( )
| A. | 乙酸 | B. | 乙醛 | C. | 甲酸乙酯 | D. | 乙醇 |
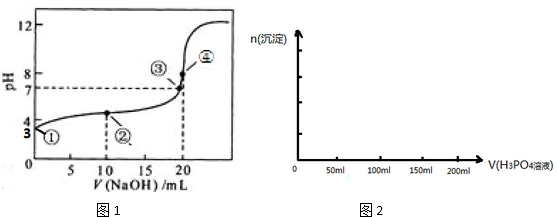
4.(1)常温下,用 0.1000mol•L-1NaOH溶液滴定 20.00mL 0.1000mol•L-1CH3COOH溶液所得滴定曲线如图1.已知起始①点溶液的pH为3,③点溶液的pH为7,则Ka(CH3COOH)=10-5
(2)在用Na2SO3溶液吸收SO2过程中,pH随n(SO32-):n(HSO32-)变化关系如下表:
0.01mol•L-1 Na2SO3溶液中通入SO2至溶液呈中性时,溶液中的所有离子的浓度由大到小的顺序是c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
(3)向0.1mol•L的NaHSO3中通入氨气至溶液呈中性时,溶液中的c(H+)、c(OH-)、c(SO32-)、c(Na+)、c(NH4+)这五种离子浓度大小关系是c(Na+)>c(SO32-)>c(NH4+)>c(H+)=c(OH-)
(4)已知Ca3(PO4)2、CaHPO4均难溶于水,而Ca(H2PO4)2易溶,在含0.1mol Ca(OH)2的澄清石灰水中逐渐加入1mol•L-1的H3PO4;请作出生成沉淀的物质的量随H3PO4滴入体积从0开始至200mL的图象.

(2)在用Na2SO3溶液吸收SO2过程中,pH随n(SO32-):n(HSO32-)变化关系如下表:
| n(SO32-):n(HSO3-) | 1:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
(3)向0.1mol•L的NaHSO3中通入氨气至溶液呈中性时,溶液中的c(H+)、c(OH-)、c(SO32-)、c(Na+)、c(NH4+)这五种离子浓度大小关系是c(Na+)>c(SO32-)>c(NH4+)>c(H+)=c(OH-)
(4)已知Ca3(PO4)2、CaHPO4均难溶于水,而Ca(H2PO4)2易溶,在含0.1mol Ca(OH)2的澄清石灰水中逐渐加入1mol•L-1的H3PO4;请作出生成沉淀的物质的量随H3PO4滴入体积从0开始至200mL的图象.
14.向氯化钡溶液中加入硫酸溶液,直至完全反应,过滤,发现滤液的质量正好等于原氯化钡溶液的质量,求原硫酸溶液的质量分数( )
| A. | 32.15% | B. | 28.07% | C. | 42.06% | D. | 44% |
13.下列有关化学平衡常数K的说法中,正确的是( )
| A. | K的大小与起始浓度有关 | B. | 温度越高,K值越大 | ||
| C. | K值越大,反应正向进行的程度越大 | D. | K值越大,反应正向进行的程度越小 |
 A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去).A$\stackrel{O_{2}}{→}$B$\stackrel{O_{2}}{→}$C
A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去).A$\stackrel{O_{2}}{→}$B$\stackrel{O_{2}}{→}$C