题目内容
4.某固体氯化钠中含有杂质氯化钙,为测定其中氯化钠的质量分数,并得到一些纯净的氯化钠,一学生进行了如下实验:①用托盘天平称取样品,向质量为20.0g的烧杯中加人样品,直到天平平衡,称得样品质量为25.0g;②向烧杯中加人适量的水,搅拌,使样品全部溶解,再滴加过量碳酸钠溶液,产生白色沉淀;③过滤,将沉淀洗涤,晾干,称得质量为1.0g(没有损失);④向滤液中滴加稍过量的稀盐酸后,将溶液蒸发,因操作不当,有少量溶液溅出,最后的氯化钠晶体4.8g.试回答有关问题.(1)称量时,被称量物应放在托盘天平的左盘.
(2)过滤时,需要用到的玻璃仪器除烧杯、漏斗外,还有玻璃棒,它的作用是引流.
(3)第④步向滤液中加入的稀盐酸目的是除去过量杂质,能否用稀硫酸代替盐酸否(填“能”或“否”),理由是会引入杂质离子硫酸根离子.
(4)样品中氯化钠的质量分数为77.8%.
分析 (1)托盘天平称量物品是左物右码;
(2)过滤装置分析可知操作需要玻璃仪器为烧杯、漏斗、玻璃棒,将需要分离的溶液沿玻璃棒注入过滤器中;
(3)沉淀钙离子加入了过量的碳酸钠需要除去,硫酸和碳酸钠反应会生成硫酸钠,引入杂质;
(4)用托盘天平称取样品,向质量为20.0g的烧杯中加人样品,直到天平平衡,称得样品质量为25.0g,样品质量=25.0g-20.0g=5.0g,沉淀为碳酸钙1.0g,依据元素守恒计算元样品中氯化钙的质量,得到氯化钠所含质量,质量分数=$\frac{氯化钠质量}{样品质量}$×100%.
解答 解:(1)托盘天平称量物品是左物右码,称量时,被称量物应放在托盘天平的左盘,故答案为:左;
(2)过滤装置分析可知操作需要玻璃仪器为烧杯、漏斗、玻璃棒,将需要分离的溶液沿玻璃棒注入过滤器中,过滤时,需要用到的玻璃仪器除烧杯、漏斗外,还有玻璃棒,起到引流的作用,故答案为:玻璃棒;引流;
(3)沉淀钙离子加入了过量的碳酸钠需要除去,④步向滤液中加入的稀盐酸目的是除去过量碳酸钠,用稀硫酸代替盐酸,硫酸和碳酸钠反应会生成硫酸钠,引入杂质,故答案为:除去过量杂质;否;会引入杂质离子硫酸根离子;
(4)用托盘天平称取样品,向质量为20.0g的烧杯中加人样品,直到天平平衡,称得样品质量为25.0g,样品质量=25.0g-20.0g=5.0g,沉淀为碳酸钙1.0g,碳酸钙物质的量n=$\frac{1.0g}{100g/mol}$=0.01mol,依据元素守恒计算元样品中氯化钙的质量=0.01mol×111g/mol=1.11g,得到氯化钠所含质量=5.0g-1.11g=3.89g,氯化钠质量分数=$\frac{氯化钠质量}{样品质量}$×100%=$\frac{3.89g}{5.0g}$×100%=77.8%,
故答案为:77.8%.
点评 本题考查了混合物的分离提纯、实验基本操作、含量计算等,掌握基础是解题关键,题目难度不大.

| A. | 氯化钠溶液显中性,可用铝制容器贮存氯化钠溶液 | |
| B. | SO2具有漂白性,可使紫色石蕊试液褪为无色 | |
| C. | 丁达尔效应是区分胶体和溶液的一种常用物理方法 | |
| D. | 在实验室里,常用电解饱和食盐水的方法制取氯气 |
| A. | 体积 | B. | 原子数 | C. | 质量 | D. | 密度 |
| A. | 无色透明的水溶液中,K+、Mg2+、I-、MnO4- | |
| B. | 有SO42-存在的溶液中:Na+、Mg2+、Ca2+、I- | |
| C. | 在强碱溶液中:Na+、K+、CO32-、NO3- | |
| D. | pH=1的NaNO3的水溶液中,NH4+、Fe2+、SO42-、Cl- |
| A. | Na2CO3 NH4Cl CH3COOH H2SO4 | |
| B. | Na2CO3 H2SO4 CH3COOH NH4Cl | |
| C. | NH4Cl H2SO4 CH3COOH Na2CO3 | |
| D. | NH4Cl CH3COOH H2SO4 Na2CO3 |
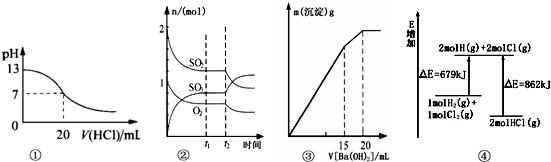
| A. | 图①表示25℃时,用0.1 mol/L盐酸滴定20 mL 0.1 mol/L NaOH溶液,溶液的pH随加入酸体积的变化得到的滴定曲线 | |
| B. | 图②表示一定条件下进行的反应2SO2(g)+O2(g)?2SO3(g)△H<0各成分的物质的量变化,t2时刻改变的条件可能是降低温度或缩小容器体积 | |
| C. | 图③表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20 mL Ba(OH)2溶液时铝离子恰好沉淀完全 | |
| D. | 图④表示化学反应H2(g)+C12(g)═2HCl(g)的能量变化,则该反应的反应热△H=﹢183 kJ/mol |


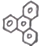 的一氯取代物有6种.
的一氯取代物有6种.