题目内容
20.将足量X气体通入Y溶液中,实验结果与预测的现象一致的组合是( )| X气体 | Y溶液 | 预测的现象 | 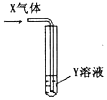 | |
| ① | CO2 | 饱和Na2CO3溶液 | 白色沉淀析出 | |
| ② | SO2 | Ba(NO3)2溶液 | 白色沉淀析出 | |
| ③ | NH3 | AgNO3溶液 | 白色沉淀析出 | |
| ④ | NH3 | AlCl3溶液 | 白色沉淀析出 |
| A. | ①②③ | B. | ①②④ | C. | ①③④ | D. | ①②③④ |
分析 ①往饱和的碳酸钠溶液中通人过量的二氧化碳,碳酸钠与水、二氧化碳反应生成了碳酸氢钠;
②SO2与Ba(NO3)2溶液发生氧化还原反应,生成硫酸钡白色沉淀;
③NH3与AgNO3溶液反应,先生成沉淀后生成银氨溶液,则先生成沉淀后沉淀消失;
④氨气溶于水生成一水合氨,一水合氨和氯化铝反应生成白色的氢氧化铝沉淀.
解答 解:①二氧化碳和碳酸钠反应生成碳酸氢钠,碳酸氢钠的溶解性小于碳酸钠的溶解性,所以向饱和的碳酸钠溶液中通入适量的二氧化碳发生Na2CO3+CO2+H2O=2NaHCO3↓,会出现白色沉淀析出,故①正确;
②SO2通入水中生成H2SO3,溶液呈酸性,NO3-在酸性条件下具有强氧化性,可发生3SO2+2H2O+2NO3-+3Ba2+=3BaSO4↓+4H++2NO↑,会出现白色沉淀析出,故②正确;
③AgNO3溶液与氨水反应生成氢氧化银沉淀,氢氧化银再和氨水发生络合反应生成可溶性络合物,现象为:先产生白色沉淀,然后沉淀逐渐溶解,故③错误;
④弱碱不能溶解氢氧化铝,氯化铝溶液加入过量氨水的反应方程式为AlCl3+3NH3•H2O═Al(OH)3↓+3NH4Cl,会出现白色沉淀析出,故④正确;
故选B.
点评 本题主要考查了实验方案的设计,注意碳酸氢钠是可溶性物质,但碳酸氢钠的溶解性小于碳酸钠的溶解性,所以适量CO2通入饱和碳酸钠溶液会出现白色沉淀,注意NO3-在酸性条件下具有强氧化性,题目难度中等.

练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案
相关题目
17.下列各组离子在溶液中能大量共存的是( )
| A. | Ca2+ Na+ NO3- Cl- | B. | Na+ K+ CO32- H+ | ||
| C. | Ba2+Cu2+ SO42- OH- | D. | Cu2+ K+ CO32- Cl- |
18.饮用水中的NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,某饮用水研究人员提出,在碱性条件下用铝粉NO3-还原为N2,反应的转化为:Al+NaNO3+NaOH→NaAlO2+N2+H2O(未配平)下列有关该反应说法不正确的是( )
| A. | NaOH表现碱性 | |
| B. | NaNO3是氧化产物,N2是还原产物 | |
| C. | 每生成1molN2转移10mole- | |
| D. | 氧化剂与还原剂物质的量之比为5:3 |
8.为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚.其反应原理如下:电池 Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l) 电解池 2Al+3H2O=Al2O3+3H2,对该电解过程,以下判断正确的是( )
| 电池 | 电解池 | |
| A | H+移向Pb电极 | H+移向Pb电极 |
| B | 每消耗6molPb] | 生成2molAl2O3 |
| C | 正极:PbO2+4H++2e-=Pb2++2H2O | 阳极:2Al+3H2O-6e-=Al2O3+6H+ |
| D | Pb电极反应质量不变 | Pb电极反应质量不变 |
| A. | A | B. | B | C. | C | D. | D |
15.下列离子方程式,书写正确的是( )
| A. | 盐酸与碳酸钡反应 CO32-+2H+═CO2↑+H2O | |
| B. | 硫酸铜溶液中滴加氢氧化钡溶液 Ba2++2OH-+Cu2++SO42-═BaSO4↓+Cu(OH)2↓ | |
| C. | 硝酸银溶液中加入铜粉 Ag++Cu═Cu2++Ag↓ | |
| D. | 铁与稀盐酸反应 2Fe+6H+═2Fe3++3H2↑ |
5.下列实验过程中产生沉淀的物质的量(Y)与加入试剂的量(X)之间的关系不正确的是( )
| A. | 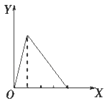 向NaAlO2溶液中滴加稀盐酸至过量且边滴边振荡 | |
| B. | 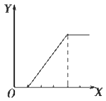 向NaHSO4溶液中逐滴加入KAlO2溶液至过量且边滴边振荡W | |
| C. |  向NH4Al(SO4)2溶液中逐滴加入氢氧化钠溶液直至过量8 | |
| D. | 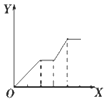 向NaOH、Ba(OH)2、NaA1O2的混合溶液中逐渐通入二氧化碳至过量 |
12.下列事实不能用化学平衡移动原理解释的是( )
| A. | 开启啤酒瓶后,瓶中立刻泛起大量泡沫 | |
| B. | 将盛有二氧化氮和四氧化二氮混合气的密闭容器置于冷水中,混合气体颜色变浅- | |
| C. | 向氯水中加CaCO3后,溶液漂白性增强 | |
| D. | 500℃左右比室温更有利于合成NH3 |
9.下列实验操作中正确的是( )
| A. | 能用分液漏斗分离碘和四氯化碳的混合物 | |
| B. | 蒸发操作时,应使混合物中的水份完全蒸干后,才能停止加热 | |
| C. | 分液操作时,下层液体从分液漏斗下口放出,上层液体从下口放出到另一个烧杯中 | |
| D. | 实验室取用液体药品做实验时,如没有说明用量,一般取1---2mL |
10.下列表示不正确的是( )
| A. | KOH的电子式: | B. | 二氧化碳的结构式:O=C=O | ||
| C. | CH4的球棍模型: | D. | S2ˉ的离子结构示意图: |