题目内容
19.设NA为阿伏加德罗常数值,下列有关叙述正确的是( )| A. | 将78gNa2O2与过量CO2反应转移的电子数为2NA | |
| B. | 1mol N2与 4mol H2反应生成的NH3 分子数为2NA | |
| C. | 标准状况下,2.24L SO3中所含原子数为0.4 NA | |
| D. | 标准状况下,18g D2O中所含电子数为9 NA |
分析 A.物质的量n=$\frac{m}{M}$,过氧化钠和二氧化碳反应生成氧气和碳酸钠,过氧化钠中氧元素化合价-1价变化为0价和-2价;
B.氮气和氢气合成氨是可能反应不能进行彻底;
C.标准状况下三氧化硫不是气体;
D.物质的量n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$,D2O分子中含10个电子.
解答 解:A.将78gNa2O2物质的量=$\frac{78g}{78g/mol}$=1mol,与过量CO2反应,过氧化钠中氧元素化合价-1价变化为0价和-2价,转移的电子数为NA,故A错误;
B.1mol N2与 4mol H2反应为可能反应,生成的NH3 分子数小于2NA,故B错误;
C.标准状况下,三氧化硫不是气体,2.24L SO3中物质的量不是0.1nol,故C错误;
D.标准状况下,18g D2O物质的量=$\frac{18g}{20g/mol}$=0.9mol,D2O中所含电子数为0.9mol×10×NA=9 NA,故D正确;
故选D.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标况下气体摩尔体积的使用条件,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
7.关于如图所示原电池装置中,叙述正确的是( )


| A. | 铜片上有气泡 | B. | 铜片为负极 | ||
| C. | 电流从锌片经导线流向铜片 | D. | 该装置将电能转化为化学能 |
11.在标准状况下,由CO和CO2组成的混合气体13.44L,质量为20g,此混合气体中C和O两种原子的物质的量之比为( )
| A. | 3:4 | B. | 4:3 | C. | 2:1 | D. | 1:2 |
9.已知化学方程式:a CuSO4+b FeS2+c H2O=d Cu2S+e FeSO4+f H2SO4,则每当1molCuSO4参加反应,转移的电子数为( )
| A. | 1.5mol | B. | 2mol | C. | 2.5mol | D. | 3mol |
 能源的开发利用与人类社会的可持续发展息息相关.
能源的开发利用与人类社会的可持续发展息息相关.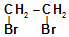 ..
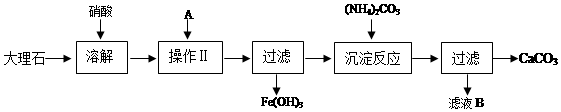
..
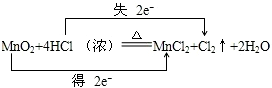 .
.