题目内容
写出下列反应的化学方程式,并指出氧化剂和还原剂.
(1)锂在空气中燃烧;
(2)钾与水反应;
(3)溴与碘化钾反应;
(4)氯化亚铁与氯气反应.
(1)锂在空气中燃烧;
(2)钾与水反应;
(3)溴与碘化钾反应;
(4)氯化亚铁与氯气反应.
考点:氧化还原反应
专题:氧化还原反应专题
分析:(1)锂在空气中燃烧反应生成氧化锂,锂元素的化合价升高,氧元素的化合价降低;
(2)钾与水反应生成氢氧化钾和氢气,钾元素的化合价升高,氢元素的化合价降低;
(3)Br2能置换出I2;
(4)Cl2具有氧化性,能氧化Fe2+.
(2)钾与水反应生成氢氧化钾和氢气,钾元素的化合价升高,氢元素的化合价降低;
(3)Br2能置换出I2;
(4)Cl2具有氧化性,能氧化Fe2+.
解答:
解:(1)锂在空气中燃烧4Li+O2
2Li2O,反应中氧元素化合价从0价变化为-2价,化合价降低得到电子,所以O2做氧化剂,锂元素的化合价从0价变化为+1价,元素化合价升高失电子,所以Li做还原剂,
答:反应为4Li+O2
2Li2O,氧化剂为O2,还原剂为Li;
(2)钾与水反应2K+2H2O=2KOH+H2↑,反应中氢元素化合价从+1价变化为0价,化合价降低得到电子,所以H2O做氧化剂,钾元素的化合价从0价变化为+1价,元素化合价升高失电子,所以K做还原剂,
答:反应为2K+2H2O=2KOH+H2↑,氧化剂为H2O,还原剂为K;
(3)溴的氧化性比碘的氧化性强,故溴单质能从KI中置换出碘单质,即Br2+2KI=I2+2KBr,Br元素的化合价降低,I元素的化合价升高,则Br2为氧化剂,KI为还原剂,
答:反应为Br2+2KI=I2+2KBr,Br2为氧化剂,KI为还原剂;
(4)Cl2 的氧化性比Fe3+的氧化性强,Cl2能氧化Fe2+,即2FeCl2+Cl2=2FeCl3,Cl元素的化合价降低,Fe元素的化合价升高,则Cl2为氧化剂,FeCl2为还原剂,
答:反应为2FeCl2+Cl2=2FeCl3,Cl2为氧化剂,FeCl2为还原剂.
| ||
答:反应为4Li+O2
| ||
(2)钾与水反应2K+2H2O=2KOH+H2↑,反应中氢元素化合价从+1价变化为0价,化合价降低得到电子,所以H2O做氧化剂,钾元素的化合价从0价变化为+1价,元素化合价升高失电子,所以K做还原剂,
答:反应为2K+2H2O=2KOH+H2↑,氧化剂为H2O,还原剂为K;
(3)溴的氧化性比碘的氧化性强,故溴单质能从KI中置换出碘单质,即Br2+2KI=I2+2KBr,Br元素的化合价降低,I元素的化合价升高,则Br2为氧化剂,KI为还原剂,
答:反应为Br2+2KI=I2+2KBr,Br2为氧化剂,KI为还原剂;
(4)Cl2 的氧化性比Fe3+的氧化性强,Cl2能氧化Fe2+,即2FeCl2+Cl2=2FeCl3,Cl元素的化合价降低,Fe元素的化合价升高,则Cl2为氧化剂,FeCl2为还原剂,
答:反应为2FeCl2+Cl2=2FeCl3,Cl2为氧化剂,FeCl2为还原剂.
点评:本题考查氧化还原反应,为高频考点,把握物质的性质、发生的反应及元素的化合价变化为解答的关键,侧重基本概念及化学方程式书写的考查,题目难度不大.

练习册系列答案
相关题目
锎是一种放射性元素,该元素的一种核素在医学上常用作治疗恶性肿瘤的中子源.下列说法正确的是( )
A、
| ||||
B、
| ||||
C、
| ||||
| D、锎元素的相对原子质量为252 |
如图为周期表前四周期的一部分,关于X、Y、Z、M的说法正确的是( )
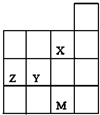

| A、Y、Z的最高价氧化物的水化物酸性为Y<Z |
| B、M的最外层电子数比Z大10 |
| C、X、M的气态氢化物的稳定性M>X |
| D、X、Y形成简单离子的最外层电子均满足8e-稳定结构 |
甲~辛等元素在周期表中的相对位置如图.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )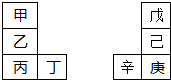

| A、金属性:甲>乙>丁 |
| B、原子半径:辛>己>戊 |
| C、丙与庚的原子核外电子数相差13 |
| D、乙的单质在空气中燃烧生成只含离子键的化合物 |
在一支50mL酸式滴定管中盛入0.1mol/L HCl溶液,其液面恰好在20mL刻度处.若把滴定管中的溶液全部放入锥形瓶中,滴人3滴酚酞试液,然后以0.1mol/L NaOH溶液进行滴定,当溶液刚好变为浅红色时,消耗NaOH镕液的体积( )
| A、等于20mL |
| B、小于20mL |
| C、等于30mL |
| D、大于30ml. |
下列实验操作中不正确的是(多选) ( )
| A、用分液的方法分离水和汽油的混合物 |
| B、用过滤的方法分离饱和食盐水与沙子的混合物 |
| C、蒸馏时,应使温度计水银球插入液面以下 |
| D、蒸发结晶时应将溶液蒸干后再停止加热 |
| E、分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |