题目内容
12.把0.6mol X气体和0.6mol Y气体混合于2L密闭容器中,使它们发生如下反应:2X(g)+Y(g)=nZ(g)+2W(g).2min 末已生成0.2mol W,若测知以Z的浓度变化表示的反应速率为0.1mol•L-1•min-1,计算:(1)前2min内用X的浓度变化表示的平均反应速率.
(2)化学反应方程式中n的值是多少?
分析 (1)根据n=$\frac{△c}{△t}$计算v(W),再利用速率之比等于化学计量数之比计算v(X);
(2)利用速率之比等于化学计量数之比计算n.
解答 解:(1)2min 末已生成0.2mol W,则v(W)=$\frac{\frac{0.2mol}{2L}}{2min}$=0.05mol/(L.min),速率之比等于化学计量数之比,则v(X)=v(W)=0.05mol/(L.min),
答:前2min内用X的浓度变化表示的平均反应速率为0.05mol/(L.min);
(2)速率之比等于化学计量数之比,则0.05mol/(L.min):0.1mol/(L.min)=2:n,解得n=4,
答:n的值为4.
点评 本题考查化学平衡计算与反应速率计算,难度不大,反应速率一般利用定义式法与反应速率规律计算.

练习册系列答案
相关题目
3.氮化硅(Si3N4)是高温结构陶瓷,具有优良的性能,人们常常利用它来制造轴承、气轮机叶片、永久性模具等机械构件.设计的合成氮化硅工艺流程如下:
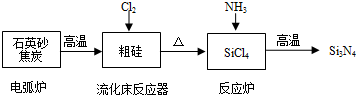
(1)①电弧炉中发生的主要反应是SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si(粗硅)+2CO↑.
②用石英砂和焦炭在电弧炉中高温加热也可以生产碳化硅,该反应的化学方程式
为SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑,碳化硅又称金刚砂,其晶体结构与金刚石相似.
(2)在流化床反应的产物中,SiCl4大约占85%,还有Cl2等,有关物质的沸点数据如下表:
提纯SiCl4的主要工艺操作依次是沉降、蒸馏,其中温度最好控制在C(填序号).
A.略小于-34.1℃B.大于57.6℃C.略小于57.6℃D.-34.1℃
(3)①粉末状Si3N4遇水能生成一种有刺激性气味、常用做制冷剂的气体和一种难溶性的酸,该反应的方程式是Si3N4+9H2O=4NH3↑+3H2SiO3↓.
②该工艺流程中涉及的主要反应属于氧化还原反应的有2个.

(1)①电弧炉中发生的主要反应是SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si(粗硅)+2CO↑.
②用石英砂和焦炭在电弧炉中高温加热也可以生产碳化硅,该反应的化学方程式
为SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑,碳化硅又称金刚砂,其晶体结构与金刚石相似.
(2)在流化床反应的产物中,SiCl4大约占85%,还有Cl2等,有关物质的沸点数据如下表:
| 物质 | Si | SiCl4 | Cl2 |
| 沸点/℃ | 2355 | 57.6 | -34.1 |
A.略小于-34.1℃B.大于57.6℃C.略小于57.6℃D.-34.1℃
(3)①粉末状Si3N4遇水能生成一种有刺激性气味、常用做制冷剂的气体和一种难溶性的酸,该反应的方程式是Si3N4+9H2O=4NH3↑+3H2SiO3↓.
②该工艺流程中涉及的主要反应属于氧化还原反应的有2个.
20.亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌.以下是过氧化氢法生产亚氯酸钠的工艺流程图: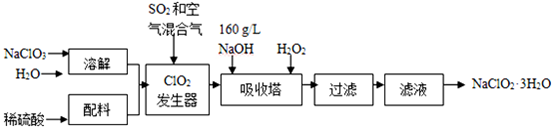
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O.
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全.
③160g•L-1 NaOH溶液是指160g NaOH固体溶于水所得溶液的体积为1L.
(1)160g•L-1 NaOH溶液的物质的量浓度为4mol/L.若要计算该溶液的质量分数,还需要的一个条件是溶液的密度(用文字说明).
(2)发生器中鼓入空气的作用可能是b(选填序号).
a.将SO2氧化成SO3,增强酸性 b.稀释ClO2以防止爆炸 c.将NaClO3氧化成ClO2
(3)吸收塔内的反应的化学方程式为2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2.吸收塔的温度不能超过20℃,其目的是防止H2O2分解.
(4)从滤液中得到NaClO2•3H2O粗晶体的实验操作是蒸发浓缩、冷却结晶、过滤
要得到更纯的NaClO2•3H2O晶体必须进行的操作是重结晶(填操作名称)
(5)经查阅资料知道:当pH≤2.0时,ClO2-能被I-完全还原成Cl-;
溶液中Na2S2O3能与I2反应生成NaI和Na2S4O6.
欲测定成品中NaClO2•3H2O的含量,现进行如下操作:
①步骤Ⅱ中发生反应的离子方程式是ClO2-+4H++4I-=2I2+Cl-+2H2O,
步骤Ⅲ中达到滴定终点时的现象是滴入最后一滴标准溶液,溶液由蓝色变化为无色且半分钟不变化.
②若上述滴定操作中用去了V mL Na2S2O3溶液,则样品中NaClO2•3H2O的质量分数为$\frac{9.05×1{0}^{-2}Vc}{4W}$×100%(用字母表示).

已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O.
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全.
③160g•L-1 NaOH溶液是指160g NaOH固体溶于水所得溶液的体积为1L.
(1)160g•L-1 NaOH溶液的物质的量浓度为4mol/L.若要计算该溶液的质量分数,还需要的一个条件是溶液的密度(用文字说明).
(2)发生器中鼓入空气的作用可能是b(选填序号).
a.将SO2氧化成SO3,增强酸性 b.稀释ClO2以防止爆炸 c.将NaClO3氧化成ClO2
(3)吸收塔内的反应的化学方程式为2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2.吸收塔的温度不能超过20℃,其目的是防止H2O2分解.
(4)从滤液中得到NaClO2•3H2O粗晶体的实验操作是蒸发浓缩、冷却结晶、过滤
要得到更纯的NaClO2•3H2O晶体必须进行的操作是重结晶(填操作名称)
(5)经查阅资料知道:当pH≤2.0时,ClO2-能被I-完全还原成Cl-;
溶液中Na2S2O3能与I2反应生成NaI和Na2S4O6.
欲测定成品中NaClO2•3H2O的含量,现进行如下操作:
| 步骤I | 称取样品w g配成溶液置于锥形瓶中,并调节pH≤2.0 |
| 步骤II | 向锥形瓶中加入足量KI 晶体,充分搅拌,并加入少量指示剂 |
| 步骤III | 用c mol/L的Na2S2O3溶液滴定 |
步骤Ⅲ中达到滴定终点时的现象是滴入最后一滴标准溶液,溶液由蓝色变化为无色且半分钟不变化.
②若上述滴定操作中用去了V mL Na2S2O3溶液,则样品中NaClO2•3H2O的质量分数为$\frac{9.05×1{0}^{-2}Vc}{4W}$×100%(用字母表示).
17.在三个密闭容器中分别充入N2、H2、HCl三种气体,当它们的温度和密度都相同时,这三种气体的压强(p),从大到小的顺序是( )
| A. | p(N2)>p(H2)>p(HCl) | B. | p(HCl)>p(N2)>p(H2) | C. | p(H2)>p(HCl)>p(N2) | D. | p(H2)>p(N2)>p(HCl) |
4. 如图是向MgCl2、AlCl3混合溶液中,开始滴加6ml试剂A,之后改滴试剂B,所得沉淀y mol与试剂体积V(ml)间的关系.以下结论不正确的是( )
如图是向MgCl2、AlCl3混合溶液中,开始滴加6ml试剂A,之后改滴试剂B,所得沉淀y mol与试剂体积V(ml)间的关系.以下结论不正确的是( )
 如图是向MgCl2、AlCl3混合溶液中,开始滴加6ml试剂A,之后改滴试剂B,所得沉淀y mol与试剂体积V(ml)间的关系.以下结论不正确的是( )
如图是向MgCl2、AlCl3混合溶液中,开始滴加6ml试剂A,之后改滴试剂B,所得沉淀y mol与试剂体积V(ml)间的关系.以下结论不正确的是( )| A. | A是NaOH,B是盐酸,且C(NaOH):C(HCl)=2:1 | |
| B. | 原混合液中,C(Al3+):C(Mg2+):C(Cl-)=1:1:5 | |
| C. | A是NaOH,B是盐酸,且C(NaOH):C(HCl)=1:2 | |
| D. | 从6到9,相应离子反应式H++OH-=H2O |
 向Ba(OH)2溶液中逐滴加入稀硫酸.请完成下列问题:
向Ba(OH)2溶液中逐滴加入稀硫酸.请完成下列问题: