题目内容
某研究性学习小组在网上收集到信息:钠、镁等活泼金属都能在CO2气体中燃烧.
他们对钠在CO2气体中燃烧后得到的白色产物进行了如下探究:
【实验操作】将燃烧的钠迅速伸入装满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底有黑色颗粒,瓶壁上附着白色物质.
【提出假设】
假设1:白色物质是Na2O.
假设2:白色物质是Na2CO3.
假设3:白色物质是Na2O和Na2CO3的混合物.
【设计方案】该小组对燃烧后生成的白色物质进行如下探究:
请回答下列问题:
(1)写出金属镁与二氧化碳反应的化学方程式 .
(2)甲同学认为方案1得到的结论不正确,其理由是 .
(3)乙同学认为方案2得到的结论正确,白色物质为 .
(4)钠在二氧化碳中燃烧的化学反应方程式为 .
(5)丙同学认为白色物质有可能是氢氧化钠.你是否同意丙同学的观点,并简述理由: .
他们对钠在CO2气体中燃烧后得到的白色产物进行了如下探究:
【实验操作】将燃烧的钠迅速伸入装满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底有黑色颗粒,瓶壁上附着白色物质.
【提出假设】
假设1:白色物质是Na2O.
假设2:白色物质是Na2CO3.
假设3:白色物质是Na2O和Na2CO3的混合物.
【设计方案】该小组对燃烧后生成的白色物质进行如下探究:
| 实验方案 | 实验操作 | 实验现象 | 结论 |
| 方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质为Na2O |
| 方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液. ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | ①出现白色沉淀.②无明显现象 | 白色物质为Na2CO3 |
(1)写出金属镁与二氧化碳反应的化学方程式
(2)甲同学认为方案1得到的结论不正确,其理由是
(3)乙同学认为方案2得到的结论正确,白色物质为
(4)钠在二氧化碳中燃烧的化学反应方程式为
(5)丙同学认为白色物质有可能是氢氧化钠.你是否同意丙同学的观点,并简述理由:
考点:探究物质的组成或测量物质的含量
专题:
分析:(1)镁在二氧化碳中燃烧生成氧化镁和碳;
(2)碳酸钠溶液水解呈碱性,氧化钠溶于水反应生成氢氧化钠溶液呈碱性,根据白色物质的水溶液呈碱性,不能得出白色物质为Na2O;
(3)依据方案①②的反应现象和结论综合分析判断;溶于水溶液呈碱性,加入过量氯化钙沉淀后的溶液遇酚酞不变色证明不含氧化钠;
(4)依据方案①②的反应现象和结论,分析和推断钠在二氧化碳中燃烧生成碳酸钠和碳;
(5)依据反应物中的元素守恒分析判断生成物的组成元素,白色物质不可能是氢氧化钠,因为反应物中没有氢元素,不会生成氢氧化钠;
(2)碳酸钠溶液水解呈碱性,氧化钠溶于水反应生成氢氧化钠溶液呈碱性,根据白色物质的水溶液呈碱性,不能得出白色物质为Na2O;
(3)依据方案①②的反应现象和结论综合分析判断;溶于水溶液呈碱性,加入过量氯化钙沉淀后的溶液遇酚酞不变色证明不含氧化钠;
(4)依据方案①②的反应现象和结论,分析和推断钠在二氧化碳中燃烧生成碳酸钠和碳;
(5)依据反应物中的元素守恒分析判断生成物的组成元素,白色物质不可能是氢氧化钠,因为反应物中没有氢元素,不会生成氢氧化钠;
解答:
解:(1)镁可以在二氧化碳中燃烧生成氧化镁和碳,反应的化学方程式是:2Mg+CO2
2MgO+C,
故答案为:2Mg+CO2
2MgO+C;
(2)取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液溶液变红,原因:可以是生成的氧化钠溶于水和水反应生成氢氧化钠溶液的作用,也可以碳酸钠溶液水解显碱性的作用,也可以是二者的混合物,所以方案1不正确,
故答案为:Na2CO3溶液显碱性,也会使酚酞试液变红,且也有可能是Na2O和Na2CO3的混合物;
(3)方案2加入过量的CaCl2溶液出现白色沉淀,是由于溶液中CO32-与Ca2+反应所致,上层清液不能使酚酞试液变红,则白色物质为Na2CO3,不含Na2O,因为氧化钠和水反应一定生成氢氧化钠溶液,所以假设2成立,说明含有碳酸钠,
故答案为:Na2CO3;
(4)依据现象和实验分析判断钠在二氧化碳气体中燃烧生成碳酸钠和碳单质,反应的化学方程式为:4Na+3CO2
2Na2CO3+C,
故答案为:4Na+3CO2
2Na2CO3+C;
(5)丙同学认为白色物质有可能是氢氧化钠.是错误的,在反应过程中,是钠在二氧化碳气体中 的燃烧反应,无氢元素的存在,实验依据元素守恒可置换不可能生成氢氧化钠,
故答案为:不同意,因为反应物中无氢元素(或违背质量守恒定律);
| ||
故答案为:2Mg+CO2
| ||
(2)取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液溶液变红,原因:可以是生成的氧化钠溶于水和水反应生成氢氧化钠溶液的作用,也可以碳酸钠溶液水解显碱性的作用,也可以是二者的混合物,所以方案1不正确,
故答案为:Na2CO3溶液显碱性,也会使酚酞试液变红,且也有可能是Na2O和Na2CO3的混合物;
(3)方案2加入过量的CaCl2溶液出现白色沉淀,是由于溶液中CO32-与Ca2+反应所致,上层清液不能使酚酞试液变红,则白色物质为Na2CO3,不含Na2O,因为氧化钠和水反应一定生成氢氧化钠溶液,所以假设2成立,说明含有碳酸钠,
故答案为:Na2CO3;
(4)依据现象和实验分析判断钠在二氧化碳气体中燃烧生成碳酸钠和碳单质,反应的化学方程式为:4Na+3CO2
| ||
故答案为:4Na+3CO2
| ||
(5)丙同学认为白色物质有可能是氢氧化钠.是错误的,在反应过程中,是钠在二氧化碳气体中 的燃烧反应,无氢元素的存在,实验依据元素守恒可置换不可能生成氢氧化钠,
故答案为:不同意,因为反应物中无氢元素(或违背质量守恒定律);
点评:本题考查物质的组成探究,为高频考点,侧重于学生的分析能力和实验能力的考查,注重于物质性质的综合应用,反应现象的分析判断,反应产物的分析判断,实验现象是解题判断的关键,题目难度中等.

练习册系列答案
相关题目
X、Y、Z、W、M均为短周期元素,X、Y同主族,X的常见氢化物和最高价氧化物的水化物能反应生成一种离子化合物;Z、W、M是第三周期原子序数连续的三种元素,其中只有一种是非金属,且原子半径Z>W>M.下列叙述正确的是( )
| A、X、M两元素的简单气态氢化物的稳定性:X<M |
| B、X、Y、M的最高价氧化物的水化物的酸性:X>Y>M |
| C、Z、W的单质均可在冷的浓硝酸中钝化 |
| D、Z、W、M 的单质均能与NaOH溶液反应 |
下列关于电解质溶液中离子关系的说法正确的是( )
| A、0.1mol?L-1NaHCO3溶液中离子浓度关系:c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3) |
| B、0.1mol?L-1NaHCO3溶液中离子浓度关系:c(OH-)+c(H2CO3)=c(H+)+c(CO32-) |
| C、0.1mol?L-1NH4Cl和0.1mol?L-1NH3?H2O等体积混合后离子浓度关系:c(Cl-)>c(NH4-)>c(H+)>c(OH-) |
| D、常温下向醋酸钠溶液中加少量醋酸使溶液pH=7,则混合溶液中:c(Na+)=c(CH3COO-) |
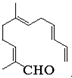 从甜橙的芳香油中可分离得到如图结构的化合物.现有试剂:①KMnO4酸性溶液;②新制Cu(OH)2;③Ag(NH3)2OH;④H2/Ni,能与该化合物中所有官能团都发生反应的试剂有( )
从甜橙的芳香油中可分离得到如图结构的化合物.现有试剂:①KMnO4酸性溶液;②新制Cu(OH)2;③Ag(NH3)2OH;④H2/Ni,能与该化合物中所有官能团都发生反应的试剂有( )
 ,该同学所画的电子排布图违背了
,该同学所画的电子排布图违背了 如图所示装置组成一种原电池.试回答下列问题:
如图所示装置组成一种原电池.试回答下列问题: A、B、D、E四种元素均为短周期元素,原子序数逐渐增大.A元素原子的核外电子数、电子层数和最外层电子数均相等.B、D、E三种元素在周期表中的相对位置如表所示,只有E元素的单质能与水反应生成两种酸.甲、乙、M、W、X、Y、Z七种物质均由A、B、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为A、B两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质;X分子含有10个电子.它们之间的转化关系如图所示.
A、B、D、E四种元素均为短周期元素,原子序数逐渐增大.A元素原子的核外电子数、电子层数和最外层电子数均相等.B、D、E三种元素在周期表中的相对位置如表所示,只有E元素的单质能与水反应生成两种酸.甲、乙、M、W、X、Y、Z七种物质均由A、B、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为A、B两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质;X分子含有10个电子.它们之间的转化关系如图所示.