题目内容
3.利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实.某化学兴趣小组通过在实验室中模拟上述过程,其设计的模拟装置如下:
(1)B装置有三种功能:①控制气流速度;②均匀混合气体;③干燥混合气体
(2)设V(Cl2)/V(CH4)=x,若理论上欲取代反应获得最多的氯化氢则x≥4
(3)D装置的石棉中均匀混有KI粉末,其作用是吸收过量的氯气.
(4)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式CH4+2Cl2$\stackrel{光照}{→}$C+4HCl.
(5)E装置中除盐酸外,还含有有机物,从E中分离出盐酸的最佳方法为A.
A.分液法 B.蒸馏法 C.萃取分液法 D.结晶法
(6)该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为AB(填编号)
A、CH4 B、CH3Cl C、CH2Cl2 D、CHCl3.
分析 在加热条件下,实验室用浓盐酸和二氧化锰反应制取氯气,在光照条件下,甲烷和氯气发生取代反应生成氯代烃和氯化氢,生成的黑色小颗粒为碳单质,氯气具有强氧化性,能将碘离子氧化生成碘单质,最后生成的氯化氢溶于水得到盐酸,互不相溶的液体采用分液的方法分离,一氯甲烷是气体,还可能有过量的甲烷,据此答题.
解答 解:在加热条件下,实验室用浓盐酸和二氧化锰反应制取氯气,在光照条件下,甲烷和氯气发生取代反应生成氯代烃和氯化氢,生成的黑色小颗粒为碳单质,氯气具有强氧化性,能将碘离子氧化生成碘单质,最后生成的氯化氢溶于水得到盐酸,互不相溶的液体采用分液的方法分离,一氯甲烷是气体,还可能有过量的甲烷,
(1)在加热条件下,二氧化锰和浓盐酸反应生成氯气,同时生成的氯气中还含有水分,浓硫酸具有吸水性、脱水性和强氧化性,所以B装置除了控制气流速度、均匀混合气体外,还有干燥作用,
故答案为:干燥混合气体;
(2)氯气与甲烷发生取代反应,反应特点是1mol氯气可取代1molH原子生成1molHCl,设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则应保证甲烷被完全取代,x应大于或等于4,
故答案为:4;
(3)氯气具有强氧化性,能将碘离子氧化生成碘单质,所以D装置的石棉中均匀混有KI粉末,其作用是吸收过量的氯气,
故答案为:吸收过量的氯气;
(4)生成的黑色小颗粒为炭黑,在强光照射下可发生CH4+2Cl2$\stackrel{光照}{→}$C+4HCl,
故答案为:CH4+2Cl2$\stackrel{光照}{→}$C+4HCl;
(5)盐酸和有机物不能互溶,所以可以采用分液的方法分离,故选A;
(6)反应生成的二氯甲烷、三氯甲烷、四氯化碳均是油状的液体,只有一氯甲烷是气体,还可能有过量的甲烷,故选AB.
点评 本题考查了氯气在制取及氯代烃的制备,明确实验原理是解本题关键,会从整体上分析各个装置发生的反应、各个装置作用,要熟练掌握甲烷的化学性质,题目难度中等.

 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案| A. | 12A/B g•mol-1 | B. | A/NA g•mol-1 | C. | 12B/A g•mol-1 | D. | A NA g•mol-1 |
| A. | 2mol | B. | 3mol | C. | 4mol | D. | 5mol |
(1)请完成下表:
| 甲同学 | 乙同学 | |
| 选用试剂 | A1C13溶液、NaOH溶液 | A12(SO4)3溶液、氨水 |
| 操作 | 向AlCl3溶液中逐滴加入NaOH溶液至过量 | 向A12(SO4)3溶液中逐滴加入氨水至过量 |
| 实验现象 | 先产生白色沉淀,然后沉淀逐渐消失 | |
| 化学方程式 | AlCl3+3NaOH=Al(OH)3↓+3NaClAl(OH)3+NaOH=NaAlO2+2H2O | A12(SO4)3+6NH3•H2O═2A1(OH)3↓+3(NH4)2SO4 |
| 离子方程式 | Al3++3OH-=Al(OH)3↓ Al(OH)3+OH-=AlO2-+2H2O | Al3++3NH3•H2O=Al(OH)3↓+3NH4+ |
(3)由甲、乙两同学的实验现象你能得出的结论有(用简要文字说明)实验室制取氢氧化铝最好选用可溶性铝盐和氨水,氢氧化铝可以和氢氧化钠溶液发生反应,和一水合氨不发生反应.
 二氧化碳是造成温室效应的主要气体,二氧化碳的回收再利用是减缓温室效应的有效途径之一.
二氧化碳是造成温室效应的主要气体,二氧化碳的回收再利用是减缓温室效应的有效途径之一.(1)二氧化碳重整可用于制取甲烷,已知:
CH4(g)+CO2(g)?2CO(g)+2H2(g)△H1=+247kJ•mol-1
CH4(g)+H2O(g)?CO(g)+3H2(g)△H2=+205kJ•mol-1
则反应CO2(g)+4H2(g)?CH4(g)+2H2O(g)的△H3=-163kJ/mol.
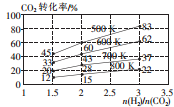
(2)一定压强下,在某恒容密闭容器中,充入H2和CO2发生反应:
2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g),其起始投料比、温度与CO2的转化率的关系如图所示.
①降低温度,平衡向逆反应 方向移动.
②在700K,起始投料比$\frac{n({H}_{2})}{n(C{O}_{2})}$=1.5时,H2 的转化率为40%.
(3)CO2和H2在一定条件下可合成二甲醚:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H.在一定压强下,将2.5molH2与a molCO2置于容积为1L的密闭容器中,发生上述反应,达到平衡状态时,测得反应的实验数据如下表:
| 温度/K CO2转化率/% a/mol | 500 | 600 | 700 | 800 |
| 1.67 | x | 33 | ||
| 1.25 | 60 | 43 | y | |
| 0.83 | z | 32 | w |
A.x=y B.x>y C.x<y D.无法判断
②下列关于该反应叙述正确的是ABC
A.该反应的△H<0,△S<0
B.该反应的平衡常数随温度升高而减小
C.转化率分别为z、w时,达到平衡的时间前者长
D.转化率分别为y、w时,平衡常数不同.
| A. | 分别加水稀释10倍,两溶液的pH仍相等 | |
| B. | 温度升高10℃,两溶液的pH均不变 | |
| C. | 加入适量的氯化铵晶体后,两溶液的pH均减小 | |
| D. | 用相同浓度的盐酸中和至反应完全时,消耗盐酸的体积相同 |
 一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
一定条件下,通过下列反应可实现燃煤烟气中硫的回收:


